
CNM365 Chào ngày mới 6 tháng 3 Wikipedia Ngày này năm xưa Bắt đầu Kinh trập tại Trung Quốc, Nhật Bản (2014). Năm 190 – Sau khi phế truất hoàng đế thiếu niên Lưu Biểu của triều Hán, Đổng Trác sai người sát hại cựu hoàng đế . Năm 1521 – Đoàn thám hiểm Tây Ban Nha của Fernão de Magalhães đổ bộ lên đảo Guam ở Tây Thái Bình Dương, bắt đầu thời kỳ thực dân châu Âu tại hòn đảo. Năm 1869 – Nhà hóa học Dmitri Mendeleev trình bày Bảng tuần hoàn (hình) đầu tiên trước Hội Hóa học Nga. Năm 1902 – Câu lạc bộ bóng đá Tây Ban Nha Real Madrid được chính thức thành lập. Năm 1946 – Pháp và Việt Nam Dân chủ Cộng hòa ký kết Hiệp định sơ bộ, công nhận nước Việt Nam Dân chủ Cộng hòa là một quốc gia tự do trong Liên bang Đông Dương và trong Liên hiệp Pháp. Năm 1957, Ghana một thuộc địa của Liên Hiệp Anh với tên gọi Bờ Biển Vàng (Gold Coast) trở thành thuộc địa đầu tiên ở vùng Châu Phi hạ Sahara giành được độc lập.
Bảng tuần hoàn
Bách khoa toàn thư mở Wikipedia
Bảng tuần hoàn các nguyên tố hóa học, hay bảng tuần hoàn Mendeleev, hay ngắn gọn bảng tuần hoàn, là một phương pháp liệt kê các nguyên tố hóa học thành bảng, liên quan mật thiết với định luật tuần hoàn.
Bảng tuần hoàn tiêu chuẩn gồm các nguyên tố được xắp xếp thành 18 cột
và 7 dòng, với hai dòng nằm riêng nằm bên dưới cùng. Bảng cũng có thể
được cấu trúc thành 4 khối hình chữ nhật gồm: khối 2 bên trái, khối p
bên phải, khối d ở giữa và khối f bên dưới.
Các nguyên tố được sắp xếp theo cấu trúc electron. Do cấu trúc electron là yếu tố quyết định các tính chất hóa học của các nguyên tố, việc sắp xếp này tạo nên sự thay đổi đều đặn của các tính chất hóa học theo các hàng và cột. Mỗi hàng được gọi là chu kỳ; các cột được gọi là nhóm ví dụ như nhóm halogen hoặc nhóm khí hiếm.
Mỗi nguyên tố được liệt kê bởi số nguyên tử và ký hiệu hóa học. Bảng tuần hoàn tiêu chuẩn cho biết các dữ liệu cơ bản nhất. Còn có nhiều các trình bày khác cho từng mục đích cụ thể hơn. Tất cả các nguyên tố có số nguyên tử từ 1 (hydro) đến 118 (ununocti) đã được phát hiện hoặc được thông báo là đã tổng hợp được, với các nguyên tố 113, 115, 117 và 118 thì chưa được xác nhận. 98 nguyên tố đầu tồn tại trong tự nhiên mặc dù một số[n 1] chỉ được tìm thấy ở dạng vết và được phát hiện ban đầu bằng quá trình tổng hợp trong phòng thí nghiệm. Các nguyên tố có số nguyên tử từ 99 đến 118 chỉ được tổng hợp ra, hoặc được tuyên bố là tồn tại, trong phòng thí nghiệm. Việc tạo ra các nguyên tố có các số nguyên tử nặng hơn vẫn đang được theo đuổi với câu hỏi rằng làm thế nào mà bảng tuần hoàn có thể cần được hiệu chỉnh để tương thích với bất kỳ sự thêm vào này vẫn là một vấn đề còn đang tranh cãi. Nhiều hạt nhân tổng hợp từ các nguyên tử trong tự nhiên cũng được tạo ra trong các phòng thí nghiệm.
Với sự phát triển của các học thuyết về cấu trúc nguyên tử (ví dụ thuyết của Henry Moseley) nó trở thành rõ ràng là Mendeleev đã sắp xếp các nguyên tố theo trật tự tăng của số nguyên tử (tức là số lượng proton trong hạt nhân). Trật tự này gần như là đồng nhất với kết quả thu được từ trật tự tăng của nguyên tử lượng.
Nhằm minh họa các thuộc tính tuần hoàn, Mendeleev đã bắt đầu các hàng mới trong bảng của mình sao cho các nguyên tố với các tính chất tương tự nhau nằm trong cùng một cột đứng ("nhóm").
Với sự phát triển của các lý thuyết trong cơ học lượng tử hiện đại về cấu hình electron trong phạm vi nguyên tử, nó trở thành rõ ràng là mỗi hàng ngang ("chu kỳ") trong bảng tuần hoàn tương ứng với sự điền đầy lớp lượng tử của các electron. Trong bảng ban đầu của Mendeleev, mỗi chu kỳ đều có độ dài như nhau. Các bảng ngày nay có các chu kỳ dài hơn tăng dần lên về phía cuối bảng, và nhóm các nguyên tố trong các khối s, p, d và f để thể hiện sự hiểu biết của con người về cấu hình electron của chúng.
Trong các bảng in ra, mỗi nguyên tố thường được thể hiện bằng ký hiệu nguyên tố và số nguyên tử; nhiều phiên bản còn liệt kê cả nguyên tử lượng và các thông tin khác, như cấu hình electron vắn tắt của chúng, độ âm điện và các hóa trị phổ biến nhất. Vào thời điểm năm 2012, bảng tuần hoàn chứa 118 nguyên tố hóa học mà sự phát hiện ra chúng đã được xác nhận. Trong số đó, 114 nguyên tố đã được IUPAC công nhận và 112 có tên chính thức. 98 nguyên tố được tìm thấy trong tự nhiên trên Trái Đất; phần còn lại là các nguyên tố tổng hợp đã được tạo ra một cách nhân tạo trong các máy gia tốc hạt.
Các nhóm được coi là phương thức quan trọng nhất trong phân loại các nguyên tố. Trong cùng một nhóm, các nguyên tố có các tính chất rất giống nhau và thể hiện một xu hướng rõ ràng (mạnh dần lên hay yếu dần đi) trong các tính chất dọc theo chiều tăng của nhóm — các nhóm này được đặt các tên gọi chung, chẳng hạn nhóm các kim loại kiềm, kim loại kiềm thổ, kim loại chuyển tiếp, halogen và khí hiếm. Một số nhóm trong bảng tuần hoàn thể hiện sự giống nhau ít hơn và/hoặc các xu hướng theo chiều đứng cũng ít hơn (ví dụ các nhóm 14 và 15). Các thuyết về cấu trúc nguyên tử trong cơ học lượng tử hiện đại giải thích rằng các nguyên tố trong cùng một nhóm có cấu hình electron như nhau trong lớp hóa trị của chúng,[1] và đây là yếu tố lớn nhất trong việc xem xét sự giống nhau của chúng về các tính chất hóa học với số nguyên tử tăng dần.[2] Tuy nhiên, trong một vào phần của bảng tuần hoàn, như lớp d và f, tính tương đồng theo chiều ngang có thể quan trọng như tính tương đồng theo chiều đứng.[3][4][5] Trong 1 nhóm A, theo chiểu tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần.
Giải thích: Trong một nhóm A, theo chiều từ trên xuống dưới, điện tích hạt nhân tăng nhưng đồng thời số lớp electron cũng tăng nhanh, chiếm ưu thế hơn nên khả năng nhận electron của nguyên tố giảm, tính phi kim giảm.[2]
Ví dụ: nhóm IA gồm các kim loại điển hình, tính kim loại tăng rõ rệt từ Li -> Cs. Cs là kim loại mạnh nhất.
Theo quy ước tên quốc tế, các nhóm được đặt theo số từ 1 đến 18 từ cột đầu tiên bên trái (các kim loại kiềm) đến cột cuối cùng bên phải (khí hiếm).[6] Trước đây, chúng được đánh thứ tự theo số La Mã. Ở Mỹ, các số La Mã được kèm theo sau hoặc chữ "A" nếu nhóm đó chỉ chứa lớp s hoặc p, hoặc chữ "B" nếu nhóm đó chứa lớp d. Các số La Mã được sử dụng tương ứng với kí tự cuối cùng của quy ước tên gọi ngày nay (như nhóm 4 là IVB, và nhóm 14 là IVA). Ở châu Âu, các kí tự cũng tương tự, trừ chữ "A" được dùng nếu nhóm nằm trước 10 và "B" được dùng cho nhóm 10 trở về sau. Ngoài ra, các nhóm 8, 9 và 10 từng được xem là một trong nhóm lớn, đều được kí hiệu là VIII. Năm 1988, hệ thống đặt tên IUPAC mới có hiệu lực, và các tên gọi nhóm cũ đã bị loại bỏ.[7]
Một số nhóm này từng bị gộp chung như bảng bên dưới, mặc dù chúng hiếm khi được sử dụng. Nhóm 3–10 không có tên chung của 3 nhóm và được xem là đơn giản bởi cac nhóm của chúng hoặc bở tên gọi của nhóm đầu tiên trong nhóm của chúng (như 'nhóm scandi' cho nhóm 3), vì chúng thể hiện các xu hướng ít tương đồng hơn theo phương đứng.[6]
Các nguyên tố cùng nhóm có khuynh hướng thể hiện các mẫu giống nhau về bán kính nguyên tử, năng lượng ion hóa, và độ âm điện. Từ trên xuống trong cùng một nhóm, bán kinh nguyên tử tăng dần. Do có nhiều mức năng lượng được lấp đầy hơn, các electron hóa trị được tìm thấy nằm xa hạt nhân hơn. Từ trên xuống, các nguyên tố sau có mức năng lượng ion hóa thấp hơn do nó dễ bị tách electron ra khỏi nguyên tử do độ liên kết không chặt. Tương tự, trong một nhóm từ trên cuống sẽ giảm độ âm điện do tăng khoảng cách giữa các electron hóa trị và hạt nhân.[8] Có một số ngoài lệ về các xu hướng này, ví dụ trong nhóm 11 thì độ âm điện tăng từ trên xuống.[9]
Mặc dù nhóm là cách thức thông dụng nhất để phân loại các nguyên tố, nhưng ở đây có một vài vùng trong bảng tuần hoàn mà các xu hướng theo chiều ngang và sự giống nhau trong các tính chất lại là đáng kể hơn so với các xu hướng theo chiều đứng. Điều này có thể là đúng trong khối d (hay "các kim loại chuyển tiếp"), và đặc biệt là trong khối f, trong đó các nguyên tố thuộc các nhóm lanthanoid và actinoid tạo ra hai nhóm cùng gốc giống nhau một cách đáng kể theo chiều ngang. Số chu kỳ cũng chỉ ra là có bao nhiêu lớp điện tử có trong nguyên tố thuộc chu kỳ đó.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố giảm dần, tính phi kim của các nguyên tố tăng dần.
Giải thích: Trong một chu kì, khi đi từ trái sang phải, điện tích hạt nhân tăng dần nhưng số lớp electron bằng nhau cho nên lực hút hạt nhân tới các electron lớp ngoài cùng tăng dần, nguyên tử dễ thu thêm electron -> tính kim loại giảm dần, tính phi kim tăng dần.
Ví dụ: Chu kì 3 bắt đầu bằng natri là một kim loại điển hình, rồi đến magie là một kim loại hoạt động mạnh nhưng kém natri, Al, một kim loại nhưng hiđrôxit mang tính chất lưỡng tính, Si là một phi kim, rồi từ P->S->Cl, tính phi kim mạnh dần, Cl là phi kim điển hình, cuối cùng là khí hiếm Ar. Qui luật trên được lặp lại trên mỗi chu kì.[11]
Kết quả là tất cả các halogen tạo ra các axit với hidro, chẳng hạn axít flohiđric, axít clohiđric, axít brômhiđric và axít iốthiđric, tất cả đều trong dạng HX. Độ axít của chúng tăng lên theo sự tăng của chu kỳ, do ion I- lớn là ổn định hơn trong dung dịch khi so với ion F- nhỏ.
Trạng thái ở nhiệt độ và áp suất tiêu chuẩn
hay cấu hình điện tử cho biết sự phân bố của electron trong lớp vỏ
nguyên tử ở các trạng thái năng lượng hay những vùng có mặt khác nhau
của chúng. Dựa vào cấu hình electron các nguyên tố được xếp vào các chu
kỳ và các nhóm khác nhau, đặt biệt là các electron ở lớp ngoài cùng.
Nguyên tố X có cấu hình electron lớp ngoài cùng là nlm, trong đó:
Bán kính nguyên tử thay đổi theo cách có thể dự đoán và giải thích
được trong toàn bảng tuần hoàn. Ví dụ, bán kính thường giảm dọch theo
mỗi chu kỳ của bảng tuần hoàn, từ các kim loại kiềm đến các khí hiếm; và
tăng theo chiều từ trên xuống trong mỗi nhóm. Bán kính tăng mạnh giữa
khí hiếm ở cuối mỗi chu kỳ và kim loại kiềm ở đầu chu kỳ tiếp theo. Các
xu hướng bán kính nguyên tử này (và nhiều tính chất vật lý và hóa học
khác của các nguyên tố) có thể được giải thích bằng thuyết lớp vỏ
electron của nguyên tử; chúng cung cấp bằng chứng quan trọng cho sự phát
triển và xác nhận học thuyết lượng tử.[14]
Các electron trong phân lớp 4f, được lấp đầy dần dần từ ceri (Z = 58) đến luteti (Z = 71), thì đặc biệt hiệu quả trong việc che chắn việc gia tăng điện tích hạt nhân từ các phân lớp ra ngoài. Các nguyên tố ngay sau nhóm lantan có bán kính nguyên tử nhỏ hơn như dự đoán và gần giống với bán kính các nguyên tử nằm ngay phía trên chúng.[15] Do đó, hafni hầu như có bán kính gần bằng với zirconi, và tantalum có bán kính nguyên tử tương tự như niobi, vv.... Điều này được gọi là nhóm lantan co. Hiệu ứng lantan co đáng chú ý nhất là platin (Z = 78), sau đó được che bởi hiệu ứng tương đối được gọi là hiệu tứng cặp trơ.[16] Co lớp d, một hiệu ứng tương tự giữa lớp d và p, ít rõ ràng hơn so với co lantan nhưng xuất phát từ cùng một nguyên nhân với lantan.[15]
Mức năng lượng ion hóa đầu tiên là năng lượng tách một electron ra
khỏi nguyên tử, mức năng lượng ion hóa thứ 2 là năng lượng tách electron
thứ 2 ra khỏi nguyên tử, và vv. Đối với một nguyên tử cho trước, các
mức năng lượng ion hóa tiếp theo tăng theo mức độ ion hóa. Ví dụ đối với
magiê, mức năng lượng ion hóa thứ 1 là 738 kJ/mol và thứ 2 là
1450 kJ/mol. Các electron quỹ đạo càng gần thì chịu lực hút tĩnh điện
càng lớn; do đó lượng năng lượng cần thiết để tách electron tăng càng
nhiều. Năng lượng ion hóa càng lớn về bên phải của bảng tuần hoàn.[16]
Các bước nhảy lớn trong năng lượng ion hóa phân tử liên tiếp xuất hiện khi một electron từ cấu hình của một khí hiếm (cầu hình bền hay đầu đủ). Ví dụ đối với magiê, năng lượng ion hóa hai phân tử đầu tiên của magiê ở trên tương ứng với việc loại 2 electron của lớp vỏ 3s, và năng lượng ion hóa thứ 3 lớn hơn rất nhiều đạt 7730 kJ/mol, để loại bỏ electron của lớp 2p, một cấu hình bền giống khí hiếm của Mg2+. Các bước nhảy tương tự đối với các năng lượng ion hóa của các nguyên tử ở chu kỳ 3.[16]
Có những ngoại lệ về nguyên tắc chung này. Galli và german có độ âm điện cao hơn nhôm và silic theo thứ tự do sự nén của lớp d. Các nguyên tố của chu kỳ 4 nằm ngay sau dòng đầu tiên của các kim loại chuyển tiếp có bán kính nhỏ bất thường do các electron 3d không có hiệu quả che chắn điện tích hạt nhân gia tăng, và kích thước nguyên tử càng nhỏ thì độ âm điện càng cao.[9] Độ âm điện cao bất thường của chù đặc biệt khi so sánh với thalli và bismuth, dường như là một tác động của các phương pháp chọn lọc dữ liệu (và dữ liệu sẵn có) trong tính toán hơn là tuân theo phương pháp Pauling thể hiện xu hướng tuần toàn bình thường của các nguyên tố này.[19]
Ái lực electron tăng theo chu kỳ. Điều này là do sự lắp đầy lớp vỏ hóa trị của nguyên tử; một nguyên tử nhóm 17 giải phóng nhiều năng lượng hơn nguyên tử nhóm 1 để có một electron vì nó có khả năng tiếp nhận 1 electron để đạt đến trạng thái bền hơn.[20]
Xu hướng giảm ái lực electron từ trên xuống trong một nhóm. Electron thêm vào sẽ lấp đầy orbitan nằm ngoài cùng của lớp vỏ. Vì electron này có thể ít bị hút vào hạt nhân và có thể giải phóng ít năng lượng khi được thêm vào. Tuy nhiên, theo chiều từ trên xuống, khoảng 1/3 các nguyên tố là bất thường, với các nguyên tố nặng hơn có ái lực electron cao hơn so với nguyên tố cùng nhóm mà nhẹ hơn. Phần lớn điều này là do sự che chắn kém bởi các electron lớp d và f. Việc giảm điều đặn ái lực electron chỉ đúng với các nguyên tử nhóm 1.[21]
Đầu thế kỷ 19, Johann Döbereiner đã lập ra bảng ghi chép mối liên hệ giữa khối lượng nguyên tử và các tính chất hóa học của từng nguyên tố. Năm 1863 John Newlands lập một bảng các nguyên tố gồm 8 nhóm. Bảng tuần hoàn đầu tiên được lập vào năm 1869 bởi Dmitri Ivanovich Mendeleev và Lothar Meyer, trong đó các nguyên tố được sắp tăng theo khối lượng nguyên tử, các nguyên tố có tính chất giống nhau được xếp thành một hàng (cùng electron hóa trị). Vào thế kỷ 20, các chu kì đã được giải thích dựa trên cấu hình electron của nguyên tố. Nên suy ra ta có bảng tuần hoàn bên trên.
Các nguyên tố được sắp xếp theo cấu trúc electron. Do cấu trúc electron là yếu tố quyết định các tính chất hóa học của các nguyên tố, việc sắp xếp này tạo nên sự thay đổi đều đặn của các tính chất hóa học theo các hàng và cột. Mỗi hàng được gọi là chu kỳ; các cột được gọi là nhóm ví dụ như nhóm halogen hoặc nhóm khí hiếm.
Mỗi nguyên tố được liệt kê bởi số nguyên tử và ký hiệu hóa học. Bảng tuần hoàn tiêu chuẩn cho biết các dữ liệu cơ bản nhất. Còn có nhiều các trình bày khác cho từng mục đích cụ thể hơn. Tất cả các nguyên tố có số nguyên tử từ 1 (hydro) đến 118 (ununocti) đã được phát hiện hoặc được thông báo là đã tổng hợp được, với các nguyên tố 113, 115, 117 và 118 thì chưa được xác nhận. 98 nguyên tố đầu tồn tại trong tự nhiên mặc dù một số[n 1] chỉ được tìm thấy ở dạng vết và được phát hiện ban đầu bằng quá trình tổng hợp trong phòng thí nghiệm. Các nguyên tố có số nguyên tử từ 99 đến 118 chỉ được tổng hợp ra, hoặc được tuyên bố là tồn tại, trong phòng thí nghiệm. Việc tạo ra các nguyên tố có các số nguyên tử nặng hơn vẫn đang được theo đuổi với câu hỏi rằng làm thế nào mà bảng tuần hoàn có thể cần được hiệu chỉnh để tương thích với bất kỳ sự thêm vào này vẫn là một vấn đề còn đang tranh cãi. Nhiều hạt nhân tổng hợp từ các nguyên tử trong tự nhiên cũng được tạo ra trong các phòng thí nghiệm.
Mục lục
Sắp xếp
Ban đầu, người ta thường cố gắng liệt kê các nguyên tố để thể hiện mối quan hệ giữa chúng bằng cách sắp xếp chúng theo thứ tự nguyên tử lượng. Mendeleev dùng vốn hiểu biết sâu sắc của mình để phát minh ra bảng tuần hoàn Mendeleev bằng cách sắp đặt các nguyên tố để minh họa sự tuần hoàn của các tính chất hóa học (mặc dù một số nguyên tố nhất định không tuân theo trật tự khối lượng, ví dụ Argon có nguyên tử lượng là 39,948(1) trong khi Kali tuy là nguyên tố xếp sau nó nhưng lại chỉ có nguyên tử lượng nhỏ hơn: 39,0983(1).), và để lại các lỗ hổng cho các nguyên tố "bị bỏ sót" (chưa tìm thấy vào thời kỳ đó). Mendeleev sử dụng bảng của mình để dự đoán các tính chất của các "nguyên tố bị bỏ sót" này, và nhiều trong số chúng sau này đã được phát hiện ra là phù hợp khá tốt với các dự đoán.Với sự phát triển của các học thuyết về cấu trúc nguyên tử (ví dụ thuyết của Henry Moseley) nó trở thành rõ ràng là Mendeleev đã sắp xếp các nguyên tố theo trật tự tăng của số nguyên tử (tức là số lượng proton trong hạt nhân). Trật tự này gần như là đồng nhất với kết quả thu được từ trật tự tăng của nguyên tử lượng.
Nhằm minh họa các thuộc tính tuần hoàn, Mendeleev đã bắt đầu các hàng mới trong bảng của mình sao cho các nguyên tố với các tính chất tương tự nhau nằm trong cùng một cột đứng ("nhóm").
Với sự phát triển của các lý thuyết trong cơ học lượng tử hiện đại về cấu hình electron trong phạm vi nguyên tử, nó trở thành rõ ràng là mỗi hàng ngang ("chu kỳ") trong bảng tuần hoàn tương ứng với sự điền đầy lớp lượng tử của các electron. Trong bảng ban đầu của Mendeleev, mỗi chu kỳ đều có độ dài như nhau. Các bảng ngày nay có các chu kỳ dài hơn tăng dần lên về phía cuối bảng, và nhóm các nguyên tố trong các khối s, p, d và f để thể hiện sự hiểu biết của con người về cấu hình electron của chúng.
Trong các bảng in ra, mỗi nguyên tố thường được thể hiện bằng ký hiệu nguyên tố và số nguyên tử; nhiều phiên bản còn liệt kê cả nguyên tử lượng và các thông tin khác, như cấu hình electron vắn tắt của chúng, độ âm điện và các hóa trị phổ biến nhất. Vào thời điểm năm 2012, bảng tuần hoàn chứa 118 nguyên tố hóa học mà sự phát hiện ra chúng đã được xác nhận. Trong số đó, 114 nguyên tố đã được IUPAC công nhận và 112 có tên chính thức. 98 nguyên tố được tìm thấy trong tự nhiên trên Trái Đất; phần còn lại là các nguyên tố tổng hợp đã được tạo ra một cách nhân tạo trong các máy gia tốc hạt.
Phương pháp xếp nhóm
Giá trị chính của bảng tuần hoàn là khả năng dự đoán các tính chất hóa học của nguyên tố, dựa trên vị trí của nó trong bảng tuần hoàn. Cũng cần lưu ý là các tính chất hóa học đó thay đổi đáng kể khi chuyển từ cột này sang cột kia hơn là khi thay đổi từ hàng này sang hàng kia.Nhóm
Một nhóm, còn gọi là một họ, là một cột thẳng đứng trong bảng tuần hoàn.Các nhóm được coi là phương thức quan trọng nhất trong phân loại các nguyên tố. Trong cùng một nhóm, các nguyên tố có các tính chất rất giống nhau và thể hiện một xu hướng rõ ràng (mạnh dần lên hay yếu dần đi) trong các tính chất dọc theo chiều tăng của nhóm — các nhóm này được đặt các tên gọi chung, chẳng hạn nhóm các kim loại kiềm, kim loại kiềm thổ, kim loại chuyển tiếp, halogen và khí hiếm. Một số nhóm trong bảng tuần hoàn thể hiện sự giống nhau ít hơn và/hoặc các xu hướng theo chiều đứng cũng ít hơn (ví dụ các nhóm 14 và 15). Các thuyết về cấu trúc nguyên tử trong cơ học lượng tử hiện đại giải thích rằng các nguyên tố trong cùng một nhóm có cấu hình electron như nhau trong lớp hóa trị của chúng,[1] và đây là yếu tố lớn nhất trong việc xem xét sự giống nhau của chúng về các tính chất hóa học với số nguyên tử tăng dần.[2] Tuy nhiên, trong một vào phần của bảng tuần hoàn, như lớp d và f, tính tương đồng theo chiều ngang có thể quan trọng như tính tương đồng theo chiều đứng.[3][4][5] Trong 1 nhóm A, theo chiểu tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần.
Giải thích: Trong một nhóm A, theo chiều từ trên xuống dưới, điện tích hạt nhân tăng nhưng đồng thời số lớp electron cũng tăng nhanh, chiếm ưu thế hơn nên khả năng nhận electron của nguyên tố giảm, tính phi kim giảm.[2]
Ví dụ: nhóm IA gồm các kim loại điển hình, tính kim loại tăng rõ rệt từ Li -> Cs. Cs là kim loại mạnh nhất.
Theo quy ước tên quốc tế, các nhóm được đặt theo số từ 1 đến 18 từ cột đầu tiên bên trái (các kim loại kiềm) đến cột cuối cùng bên phải (khí hiếm).[6] Trước đây, chúng được đánh thứ tự theo số La Mã. Ở Mỹ, các số La Mã được kèm theo sau hoặc chữ "A" nếu nhóm đó chỉ chứa lớp s hoặc p, hoặc chữ "B" nếu nhóm đó chứa lớp d. Các số La Mã được sử dụng tương ứng với kí tự cuối cùng của quy ước tên gọi ngày nay (như nhóm 4 là IVB, và nhóm 14 là IVA). Ở châu Âu, các kí tự cũng tương tự, trừ chữ "A" được dùng nếu nhóm nằm trước 10 và "B" được dùng cho nhóm 10 trở về sau. Ngoài ra, các nhóm 8, 9 và 10 từng được xem là một trong nhóm lớn, đều được kí hiệu là VIII. Năm 1988, hệ thống đặt tên IUPAC mới có hiệu lực, và các tên gọi nhóm cũ đã bị loại bỏ.[7]
Một số nhóm này từng bị gộp chung như bảng bên dưới, mặc dù chúng hiếm khi được sử dụng. Nhóm 3–10 không có tên chung của 3 nhóm và được xem là đơn giản bởi cac nhóm của chúng hoặc bở tên gọi của nhóm đầu tiên trong nhóm của chúng (như 'nhóm scandi' cho nhóm 3), vì chúng thể hiện các xu hướng ít tương đồng hơn theo phương đứng.[6]
Các nguyên tố cùng nhóm có khuynh hướng thể hiện các mẫu giống nhau về bán kính nguyên tử, năng lượng ion hóa, và độ âm điện. Từ trên xuống trong cùng một nhóm, bán kinh nguyên tử tăng dần. Do có nhiều mức năng lượng được lấp đầy hơn, các electron hóa trị được tìm thấy nằm xa hạt nhân hơn. Từ trên xuống, các nguyên tố sau có mức năng lượng ion hóa thấp hơn do nó dễ bị tách electron ra khỏi nguyên tử do độ liên kết không chặt. Tương tự, trong một nhóm từ trên cuống sẽ giảm độ âm điện do tăng khoảng cách giữa các electron hóa trị và hạt nhân.[8] Có một số ngoài lệ về các xu hướng này, ví dụ trong nhóm 11 thì độ âm điện tăng từ trên xuống.[9]
Chu kỳ
Một chu kỳ là một hàng ngang trong bảng tuần hoàn gồm những nguyên tố có cùng số lớp electron. Trong một chu kì theo chiều tăng của Z, bán kính nguyên tử giảm dần, độ âm điện và năng lượng ion hóa tăng dần, do đó khả năng nhường e của nguyên tố giảm, đồng thời khả năng nhận e của nguyên tố tăng dần. Do đó trong một chu kì thì tính kim loại giảm còn tính phi kim tăng dần.[10]Mặc dù nhóm là cách thức thông dụng nhất để phân loại các nguyên tố, nhưng ở đây có một vài vùng trong bảng tuần hoàn mà các xu hướng theo chiều ngang và sự giống nhau trong các tính chất lại là đáng kể hơn so với các xu hướng theo chiều đứng. Điều này có thể là đúng trong khối d (hay "các kim loại chuyển tiếp"), và đặc biệt là trong khối f, trong đó các nguyên tố thuộc các nhóm lanthanoid và actinoid tạo ra hai nhóm cùng gốc giống nhau một cách đáng kể theo chiều ngang. Số chu kỳ cũng chỉ ra là có bao nhiêu lớp điện tử có trong nguyên tố thuộc chu kỳ đó.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố giảm dần, tính phi kim của các nguyên tố tăng dần.
Giải thích: Trong một chu kì, khi đi từ trái sang phải, điện tích hạt nhân tăng dần nhưng số lớp electron bằng nhau cho nên lực hút hạt nhân tới các electron lớp ngoài cùng tăng dần, nguyên tử dễ thu thêm electron -> tính kim loại giảm dần, tính phi kim tăng dần.
Ví dụ: Chu kì 3 bắt đầu bằng natri là một kim loại điển hình, rồi đến magie là một kim loại hoạt động mạnh nhưng kém natri, Al, một kim loại nhưng hiđrôxit mang tính chất lưỡng tính, Si là một phi kim, rồi từ P->S->Cl, tính phi kim mạnh dần, Cl là phi kim điển hình, cuối cùng là khí hiếm Ar. Qui luật trên được lặp lại trên mỗi chu kì.[11]
Lớp
Các vùng khác nhau trên bản tuần hoàn đôi khi được xem là "lớp" theo cách mà các vỏ electron của các nguyên tố được lấp đầy. Mỗi lớp được đặt tên theo sự sắp xếp các electron cuối cùng trong vỏ.[12][n 2] Lớp s gồm hai nhóm đầu tiên (kim loại kiềm và kiềm thổ) ví dụ như hydro và heli. Lớp p gồm 6 nhóm cuối từ số 13 đến 18 theo IUPAC (3A đến 8A theo Mỹ) và chứa tất cả các bán kim. Lớp d gồm các nhóm thứ 3 đến 12 theo IUPAC (hoặc 3B tđến 2B theo Mỹ) và chứa tất cả kim loại chuyển tiếp. Lớp f, thường xếp riêng bên dưới bản tuần hoàn, gồm các họ lantan và actini.[13]Ví dụ
Khí hiếm
Tất cả các nguyên tố của nhóm 18 (8 hay 0 nếu không kể đến các nguyên tố chuyển tiếp), là các khí hiếm (khí quý), có lớp hóa trị được điền đầy. Ngày nay người ta không gọi chúng là khí trơ nữa, vì đã tìm thấy hợp chất của Xe. Helium là nguyên tố trơ nhất trong các khí hiếm và khả năng phản ứng trong nhóm này tăng dần lên theo chu kỳ: có thể làm cho các khí hiếm nặng nhất phản ứng do chúng có các lớp electron lớn hơn. Tuy nhiên, khả năng phản ứng của chúng về tổng thể vẫn là rất thấp và kém.Halogen
Trong nhóm 17 (7 nếu loại đi các kim loại chuyển tiếp) được biết đến như là nhóm các halogen, các nguyên tố đều chỉ còn thiếu 1 electron là điền đầy lớp điện tử hóa trị. Vì thế, trong các phản ứng hóa học chúng có xu hướng thu thêm điện tử (xu hướng thu thêm điện tử gọi là độ âm điện). Thuộc tính này là rõ nét nhất ở Flo (nguyên tố có độ âm điện lớn nhất trong tất cả các nguyên tố) và nó giảm dần theo sự tăng lên của chu kỳ.Kết quả là tất cả các halogen tạo ra các axit với hidro, chẳng hạn axít flohiđric, axít clohiđric, axít brômhiđric và axít iốthiđric, tất cả đều trong dạng HX. Độ axít của chúng tăng lên theo sự tăng của chu kỳ, do ion I- lớn là ổn định hơn trong dung dịch khi so với ion F- nhỏ.
Kim loại chuyển tiếp
Trong các kim loại chuyển tiếp (các nhóm từ 3 đến 12), sự khác nhau giữa các nhóm là không quá lớn, và các phản ứng diễn ra ở trạng thái hỗn hợp, tuy nhiên, vẫn có thể thực hiện các dự đoán có ích tại đây được.Các nhóm Lantan và Actini
Các tính chất hóa học của nhóm Lantan (các nguyên tố từ 57 đến 71) và nhóm actini (các nguyên tố từ 89 đến 103) là rất giống nhau trong nội nhóm hơn là giống các kim loại chuyển tiếp khác, và việc tách hỗn hợp các nguyên tố này có thể là rất khó. Nó là quan trọng trong sự làm tinh khiết hóa học cho urani (số nguyên tử bằng 92), một nguyên tố quan trọng trong năng lượng nguyên tử.Bảng tuần hoàn tiêu chuẩn
| Nhóm → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| ↓ Chu kỳ | |||||||||||||||||||
| 1 | 1 H |
2 He |
|||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
|||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
|||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
|
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
|
| 6 | 55 Cs |
56 Ba |
* | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
|
| 7 | 87 Fr |
88 Ra |
** | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Uut |
114 Fl |
115 Uup |
116 Lv |
117 Uus |
118 Uuo |
|
| * Nhóm lantan | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
||||
| ** Nhóm actini | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
||||
| Kim loại kiềm | Kim loại kiềm thổ | Nhóm lantan | Nhóm actini | Kim loại chuyển tiếp |
| Kim loại yếu | Á kim | Phi kim | Halogen | Khí trơ |
| Thuộc tính hóa học không rõ |
- Màu số nguyên tử đỏ là chất khí ở nhiệt độ và áp suất tiêu chuẩn
- Màu số nguyên tử lục là chất lỏng ở nhiệt độ và áp suất tiêu chuẩn
- Màu số nguyên tử đen là chất rắn ở nhiệt độ và áp suất tiêu chuẩn
-
Viền liền: có đồng vị già hơn Trái Đất (chất nguyên thủy)
-
Viền gạch gạch: thường sinh ra từ phản ứng phân rã các nguyên tố khác, không có đồng vị già hơn Trái Đất (hiện tượng hóa học)
-
Viền chấm chấm: tạo ra trong phòng thí nghiệm (nguyên tố nhân tạo)
-
Không có viền: chưa tìm thấy
Xu hướng tuần hoàn
Cấu hình electron
| Lớp | ||||||
| Chu kỳ | s | f | d | p | ||
| 1 | 1s | |||||
| 2 | 2s | 2p | ||||
| 3 | 3s | 3p | ||||
| 4 | 4s | 3d | 4p | |||
| 5 | 5s | 4d | 5p | |||
| 6 | 6s | 4f | 5d | 6p | ||
| Các lớp electron có thể theo chu kỳ | ||||||
- n: số lượng tử chính = số chu kỳ, với n = 1, 2, 3,...
- l: số lượng tử phụ, có giá trị từ 0 đến n-1, tương ứng với các lớp s, p, d, f,...
- m: số lượng tử từ, tổng electron lớp ngoài cùng = số nhóm, với m = 1, 2, 3,...
Bán kính nguyên tử
Các electron trong phân lớp 4f, được lấp đầy dần dần từ ceri (Z = 58) đến luteti (Z = 71), thì đặc biệt hiệu quả trong việc che chắn việc gia tăng điện tích hạt nhân từ các phân lớp ra ngoài. Các nguyên tố ngay sau nhóm lantan có bán kính nguyên tử nhỏ hơn như dự đoán và gần giống với bán kính các nguyên tử nằm ngay phía trên chúng.[15] Do đó, hafni hầu như có bán kính gần bằng với zirconi, và tantalum có bán kính nguyên tử tương tự như niobi, vv.... Điều này được gọi là nhóm lantan co. Hiệu ứng lantan co đáng chú ý nhất là platin (Z = 78), sau đó được che bởi hiệu ứng tương đối được gọi là hiệu tứng cặp trơ.[16] Co lớp d, một hiệu ứng tương tự giữa lớp d và p, ít rõ ràng hơn so với co lantan nhưng xuất phát từ cùng một nguyên nhân với lantan.[15]
Năng lượng ion hóa
Các bước nhảy lớn trong năng lượng ion hóa phân tử liên tiếp xuất hiện khi một electron từ cấu hình của một khí hiếm (cầu hình bền hay đầu đủ). Ví dụ đối với magiê, năng lượng ion hóa hai phân tử đầu tiên của magiê ở trên tương ứng với việc loại 2 electron của lớp vỏ 3s, và năng lượng ion hóa thứ 3 lớn hơn rất nhiều đạt 7730 kJ/mol, để loại bỏ electron của lớp 2p, một cấu hình bền giống khí hiếm của Mg2+. Các bước nhảy tương tự đối với các năng lượng ion hóa của các nguyên tử ở chu kỳ 3.[16]
Độ âm điện
Có những ngoại lệ về nguyên tắc chung này. Galli và german có độ âm điện cao hơn nhôm và silic theo thứ tự do sự nén của lớp d. Các nguyên tố của chu kỳ 4 nằm ngay sau dòng đầu tiên của các kim loại chuyển tiếp có bán kính nhỏ bất thường do các electron 3d không có hiệu quả che chắn điện tích hạt nhân gia tăng, và kích thước nguyên tử càng nhỏ thì độ âm điện càng cao.[9] Độ âm điện cao bất thường của chù đặc biệt khi so sánh với thalli và bismuth, dường như là một tác động của các phương pháp chọn lọc dữ liệu (và dữ liệu sẵn có) trong tính toán hơn là tuân theo phương pháp Pauling thể hiện xu hướng tuần toàn bình thường của các nguyên tố này.[19]
Ái lực
Ái lực electron tăng theo chu kỳ. Điều này là do sự lắp đầy lớp vỏ hóa trị của nguyên tử; một nguyên tử nhóm 17 giải phóng nhiều năng lượng hơn nguyên tử nhóm 1 để có một electron vì nó có khả năng tiếp nhận 1 electron để đạt đến trạng thái bền hơn.[20]
Xu hướng giảm ái lực electron từ trên xuống trong một nhóm. Electron thêm vào sẽ lấp đầy orbitan nằm ngoài cùng của lớp vỏ. Vì electron này có thể ít bị hút vào hạt nhân và có thể giải phóng ít năng lượng khi được thêm vào. Tuy nhiên, theo chiều từ trên xuống, khoảng 1/3 các nguyên tố là bất thường, với các nguyên tố nặng hơn có ái lực electron cao hơn so với nguyên tố cùng nhóm mà nhẹ hơn. Phần lớn điều này là do sự che chắn kém bởi các electron lớp d và f. Việc giảm điều đặn ái lực electron chỉ đúng với các nguyên tử nhóm 1.[21]
Tính kim loại
Năng lượng ion hóa, độ âm điện và ái lực electron càng thấp thì tính kim loại càng mạnh. Ngược lại tính phi kim tăng thì cá giá trị trên càng lớn.[22] Tính kim loại có khuynh hướng giảm trong cùng chu kỳ và với một số bất thường do sự sàng lọc kém của các hạt nhân bởi các electron d và f và hiểu ứng tương đối,[23] có khuynh hướng tăng dần trong một nhóm. Vì vậy, hầu hết các nguyên tố kim loại (như caesi và franxi) được tìm thấy ở góc dưới bên trái của bảng tuần hoàn truyền thống và hầy hết các nguyên tố phi kim (ôxy, flo, clo) ở góc trên bên phải. Sự kết hợp các xu hướng theo chiều đứng và ngang theo tính kim loại giải thích ranh giới phân chia rõ ràng giữa các kim loại và phi kim trên một số bảng tuần hoàn, và việc xếp nhóm một số nguyên tố nằm cạnh đường ranh này hoặc các nguyên tố nằm cạnh các nguyên tố này là á kim loại.[24][25]Lịch sử
Sự ghi chép và sắp xếp các nguyên tố đã có từ rất xa, từ thời cổ đại, đặt biệt là từ thế kỷ 18 đã có những bảng liệt kê hơn 15 nguyên tố. Phần lớn các nguyên tố được phát hiện trong thế kỷ 19 và được ghi chép một cách khoa học. Đầu thế kỷ 20 chỉ khoảng 10 nguyên tố tự nhiên nữa được phát hiện, các nguyên tố còn lại là các nguyên tố nhân tạo và có tính phóng xạ. Tận đến tháng 12 năm 1994, hai nguyên tố nhân tạo là darmstadti (Ds) và roentgeni (Rg) mới được tạo ra.Đầu thế kỷ 19, Johann Döbereiner đã lập ra bảng ghi chép mối liên hệ giữa khối lượng nguyên tử và các tính chất hóa học của từng nguyên tố. Năm 1863 John Newlands lập một bảng các nguyên tố gồm 8 nhóm. Bảng tuần hoàn đầu tiên được lập vào năm 1869 bởi Dmitri Ivanovich Mendeleev và Lothar Meyer, trong đó các nguyên tố được sắp tăng theo khối lượng nguyên tử, các nguyên tố có tính chất giống nhau được xếp thành một hàng (cùng electron hóa trị). Vào thế kỷ 20, các chu kì đã được giải thích dựa trên cấu hình electron của nguyên tố. Nên suy ra ta có bảng tuần hoàn bên trên.
Xem thêm
Các cách trình bày khác
- Bảng tiêu chuẩn
- Bảng tuần hoàn dọc để xem dễ hơn trên trình duyệt mạng
- Bảng tuần hoàn lớn
- Bảng tuần hoàn rất lớn
- Bảng tuần hoàn rộng cho Lantan và Actini vào bảng
- 218 nguyên tố thêm các nguyên tố chưa tìm thấy...
Ghi chú
- ^ The elements discovered initially by synthesis and later in nature are technetium (Z=43), promethium (61), astatine (85), francium (87), neptunium (93), plutonium (94), americium (95), curium (96), berkelium (97) and californium (98).
- ^ There is an inconsistency and some irregularities in this convention. Thus, helium is shown in the p-block but is actually an s-block element, and (for example) the d-subshell in the d-block is actually filled by the time group 11 is reached, rather than group 12.
- ^ The noble gases, astatine, francium, and all elements heavier than americium were left out as there is no data for them.
- ^ While fluorine is the most electronegative of the elements under the Pauling scale, neon is the most electronegative element under other scales, such as the Allen scale.
Chú thích
- ^ Scerri 2007, p. 24
- ^ Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. tr. 32. ISBN 0763778338.
- ^ Bagnall, K. W. (1967). “Recent advances in actinide and lanthanide chemistry”. Trong Fields, PR; Moeller, T. Advances in chemistry, Lanthanide/Actinide chemistry. Advances in Chemistry 71. American Chemical Society. tr. 1–12. doi:10.1021/ba-1967-0071. ISBN 0-8412-0072-6
- ^ Day, M. C.; Selbin, J. (1969). Theoretical inorganic chemistry (ấn bản 2). New York, MA: Reinhold Book Corporation. tr. 103. ISBN 0763778338.
- ^ Holman, J.; Hill, G. C. (2000). Chemistry in context (ấn bản 5). Walton-on-Thames: Nelson Thornes. tr. 40. ISBN 0174482760.
- ^ a b Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 0-632-02494-1.
- ^ Fluck, E. (1988). “New Notations in the Periodic Table”. Pure Appl. Chem. (IUPAC) 60 (3): 431–436. doi:10.1351/pac198860030431. Truy cập ngày 24 tháng 3 năm 2012.
- ^ Moore, p. 111
- ^ a b c Greenwood, p. 30
- ^ Mascetta, Joseph (2003). Chemistry The Easy Way (ấn bản 4). New York: Hauppauge. tr. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- ^ [1]
- ^ Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có tênGray12 - ^ Jones, Chris (2002). d- and f-block chemistry. New York: J. Wiley & Sons. tr. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
- ^ Greenwood, p. 27
- ^ a b Jolly, W. L. (1991). Modern Inorganic Chemistry (ấn bản 2). McGraw-Hill. tr. 22. ISBN 978-0-07-112651-9.
- ^ a b c Greenwood, p. 28
- ^ International Union of Pure and Applied Chemistry. "Electronegativity". Toàn văn bản Giản Lược Thuật Ngữ Hoá Học.
- ^ Pauling, L. (1932). “The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms”. Journal of the American Chemical Society 54 (9): 3570–3582. doi:10.1021/ja01348a011.
- ^ Allred, A. L. (1960). “Electronegativity values from thermochemical data”. Journal of Inorganic and Nuclear Chemistry (Northwestern University) 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5. Truy cập ngày 11 tháng 6 năm 2012.
- ^ a b Chang, pp. 307–309
- ^ Huheey, Keiter & Keiter, pp. 42, 880–81
- ^ Yoder, C. H.; Suydam, F. H.; Snavely, F. A. (1975). Chemistry (ấn bản 2). Harcourt Brace Jovanovich. tr. 58. ISBN 0-15-506465-7.
- ^ Huheey, Keiter & Keiter, pp. 880–85
- ^ Sacks, O (2009). Uncle Tungsten: Memories of a chemical boyhood. New York: Alfred A. Knopf. tr. 191, 194. ISBN 0-375-70404-3.
- ^ Gray, p. 9
Liên kết ngoài
| Wikimedia Commons có thêm thể loại hình ảnh và tài liệu về Bảng tuần hoàn |
- Bảng tuần hoàn chính thức của IUPAC
- Trang thông tin về các nguyên tố
- Bảng tuần hoàn
- Nguyên tố hóa học mới trong bảng tuần hoàn (Tiếng Việt)
| [ẩn]
Bảng tuần hoàn |
||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||||||||||
|
||||||||||||||||||||||||||||||||||||||||||
Thể loại:
Dmitri Ivanovich Mendeleev (cũng được La tinh hoá là Mendeleyev hay Mendeleef; tiếng Nga: Дми́трий Ива́нович Менделе́ев ) (8 tháng 2 [cũ 27 tháng 1] năm 1834 – 2 tháng 2 [cũ 20 tháng 1] năm 1907), là một nhà hoá học và nhà phát minh người Nga. Ông được coi là người tạo ra phiên bản đầu tiên của bảng tuần hoàn các nguyên tố hoá học. Sử dụng bảng tuần hoàn này, ông đã dự đoán các tính chất của các nguyên tố còn chưa được phát hiện.
Mendeleev được cho là con út trong số 14 anh chị em, nhưng con số chính xác khác biệt tuỳ theo từng nguồn tin.[3] Khi 13 tuổi, sau khi cha ông qua đời và nhà máy của mẹ bị phá huỷ bởi hoả hoạn, Mendeleev theo học trung học tại Tobolsk.
Năm 1849, khi ấy gia đình Mendeleev đã nghèo túng chuyển tới Saint Petersburg, nơi ông vào Viện Sư phạm Main năm 1850. Sau khi tốt nghiệp, bệnh lao khiến ông phải chuyển tới Bán đảo Krym ở bờ biển phía bắc của Hắc Hải năm 1855. Tại đây ông trở thành một giáo viên khoa học tại Trường trung học số 1 Simferopol. Ông trở lại Saint Petersburg với sức khoẻ đã phục hồi hoàn toàn năm 1857.
Giai đoạn 1859 và 1861, ông làm việc về tính mao dẫn của các chất lỏng và kính quang phổ tại Heidelberg. Cuối tháng 8 năm 1861 ông viết cuốn sách đầu tiên về kính quang phổ. Ngày 4 tháng 4 năm 1862 ông hứa hôn với Feozva Nikitichna Leshcheva, và họ cưới ngày 27 tháng 4 năm 1862 tại nhà thờ của Trường Cao đẳng Cơ khí Nikolaev ở Saint Petersburg.[4] Mendeleev trở thành Giáo sư Hoá học tại Viện Công nghệ Nhà nước Saint Petersburg và Đại học Nhà nước Saint Petersburg năm 1863. Năm 1865 ông trở thành Tiến sĩ Khoa học với luận văn "Về những hoá hợp của Nước và Rượu". Ông được bổ nhiệm năm 1867, và tới năm 1871 đã biến Saint Petersburg thành một trung tâm được quốc tế công nhận trong lĩnh vực nghiên cứu hoá học. Năm 1876, ông say mê Anna Ivanova Popova và bắt đầu tán tỉnh bà, năm 1881 ông cầu hôn bà và đe doạ sẽ tự tử nếu bị từ chối. Cuộc li dị của ông với Leshcheva kết thúc một tháng sau khi ông đã cưới (ngày 2 tháng 4[5]) đầu năm 1882. Thậm chí sau khi li dị, Mendeleev về kỹ thuật vẫn là một người mắc tội lấy một người khác khi vẫn con trong hôn nhân; Nhà thờ Chính thống Nga yêu cầu phải có ít nhất 7 năm trước khi tái hôn một cách hợp pháp. Cuộc hôn nhân của ông và sự tranh cãi xung quanh nó góp phần khiến ông không thể được chấp nhận vào Viện Hàn lâm Khoa học Nga (dù danh tiếng quốc tế của ông vào thời điểm đó). Con gái ông từ cuộc hôn nhân thứ hai, trở thành vợ của nhà thơ Nga nổi tiếng Alexander Blok. Những người con khác của ông là con trai Vladimir (một thuỷ thủ, ông tham gia vào Chuyến đi về phía Đông của Nicholas II nổi tiếng) và con gái Olga, từ cuộc hôn nhân đầu tiên với Feozva, và con trai Ivan và một cặp sinh đôi với Anna.
Dù Mendeleev được các tổ chức khoa học trên khắp châu Âu ca tụng, gồm cả Huy chương Copley từ Viện Hoàng gia London, ông đã từ chức khỏi Đại học Saint Petersburg ngày 17 tháng 8 năm 1890.
Năm 1893, ông được chỉ định làm Giám đốc Phòng Cân và Đo lường. Chính trong vai trò này ông đã được giao trách nhiệm hình thành những tiêu chuẩn nhà nước mới cho việc sản xuất vodka. Nhờ công việc của ông, năm 1894 các tiêu chuẩn mới cho vodka được đưa vào trong luật Nga và mọi loại vodka phải được sản xuất với nồng độ 40% cồn.[6]
Mendeleev cũng nghiên cứu thành phần của các giếng dầu, và giúp thành lập nhà máy lọc dầu đầu tiên tại Nga.
Năm 1905, Mendeleev được bầu làm một thành viên của Viện Hàn lâm Khoa học Hoàng gia Thuỵ Điển. Năm sau Hội đồng Nobel Hoá học đã đề xuất với Viện Hàn lâm Thuỵ Điển trao Giải Nobel Hoá học năm 1906 cho Mendeleev vì phát minh ra bảng tuần hoàn của ông. Ban Hoá học của Viện Hàn lâm Thuỵ Điển đã ủng hộ đề xuất này. Viện Hàn lâm sau đó dường như đã ủng hộ lựa chọn của Uỷ ban như họ đã làm trong hầu hết mọi trường hợp. Không may thay, tại cuộc họp toàn thể của Viện, một thành viên bất mãn của Uỷ ban Nobel, Peter Klason, đề xuất tư cách ứng cử viên cho Henri Moissan người được ông ưa thích. Svante Arrhenius, dù không phải là một thành viên của Uỷ ban Nobel Hoá học, có rất nhiều ảnh hưởng trong Viện và cũng gây sức ép để loại bỏ Mendeleev, cho rằng bảng tuần hoàn quá cũ để được công nhận sự khám phá ra nó vào năm 1906. Theo những người thời đó, Arrhenius có động cơ từ sự đố kỵ của ông với Mendeleev vì Mendeleev chỉ trích lý thuyết phân ly của Arrhenius. Sau những cuộc tranh cãi nảy lửa, đa số thành viên Viện Hàn lâm bỏ phiếu cho Moissan. Những nỗ lực để đề cử Mendeleev năm 1907 một lần nữa không thành công bởi sự phản đối kịch liệt của Arrhenius.[7]
Năm 1907, Mendeleev mất ở tuổi 72 tại Saint Petersburg vì bệnh cúm. Miệng núi lửa Mendeleev trên Mặt trăng, cũng như nguyên tố số 101, chất phóng xạ mendelevium, được đặt theo tên ông.
Công trình do những người khác thực hiện hồi những năm 1860 cho rằng các nguyên tố có tính tuần hoàn. John Newlands,
người xuất bản cuốn Định luật các Quãng tám (Law of Octaves) năm 1865.
Sự thiếu hụt các khoảng trống cho những nguyên tố còn chưa được khám phá
và việc đặt hai nguyên tố trong một ô đã bị chỉ trích và các ý tưởng
của ông không được chấp nhận. Một công trình khác là của Lothar Meyer,
người xuất bản một cuốn sách năm 1864, miêu tả 28 nguyên tố. Không công
trình nào tìm cách dự đoán các nguyên tố mới. Năm 1863 đã có 56 nguyên
tố được biết với một nguyên tố mới được khám phá với tốc độ xấp xỉ một
nguyên tố mỗi năm.
Sau khi trở thành một giáo viên, Mendeleev đã viết cuốn sách hai tập cuối cùng ở thời điểm đó: Principles of Chemistry (Các nguyên tắc của Hoá học) (1868-1870). Khi ông tìm cách sắp xếp các nguyên tố theo các tính chất hoá học của chúng, ông nhận thấy các mẫu hình dẫn ông tới ý tưởng Bảng tuần hoàn. Mendeleev không hề biết về các công trình khác với các bảng tuần hoàn khác đang diễn ra trong thập niên 1860. Ông đã làm bảng sau, và bằng cách thêm các nguyên tố thêm theo mô hình này, phát triển phiên bản mở rộng của bảng tuần hoàn.[8][9]
Ngày 6 tháng 3 năm 1869, Mendeleev có cuộc giới thiệu chính thức với Viện Hoá học Nga, với tiêu đề The Dependence between the Properties of the Atomic Weights of the Elements (Sự phụ thuộc giữa các Tính chất của Trọng lượng Nguyên tử của các Nguyên tố), miêu tả các nguyên tố theo cả trọng lượng nguyên tử và hoá trị. Cuộc trình bày này nói rằng
Về tám nguyên tố do ông dự đoán, ông đã sử dụng các hậu tố eka, dvi, và tri (tiếng Phạn một, hai, ba) trong việc đặt tên chúng. Mendeleev đã nghi ngờ một số trọng lượng nguyên tử hiện đã được chấp nhận (chúng chỉ có thể được đo với một độ chính xác khá thấp ở thời điểm đó), chỉ ra rằng chúng không tương ứng với những tính chất do Bảng tuần hoàn của ông chỉ ra. Ông lưu ý rằng tellurium có trọng lượng nguyên tử lớn hơn iodine, nhưng ông đặt nó vào trật tự đúng, dự đoán không chính xác rằng những trọng lượng nguyên tử đã được chấp nhận ở thời điểm đó là sai. Ông đã gặp khó xử khi tìm nơi đặt các lanthanide đã biết, và dự đoán sự tồn tại của hàng khác trong bảng là nơi đặt các actinide có một trong số các khối lượng nguyên tử nặng nhất. Một số người không chấp nhận việc Mendeleev dự đoán rằng sẽ còn có các nguyên tố khác, nhưng đã bị chứng minh là sai lầm khi Ga (gallium) và Ge (germanium) được tìm ra năm 1875 và 1886, trùng khớp một cách chính xác vào hai khoảng trống.[10]
Bằng cách đặt những cái tên tiếng Phạn cho các nguyên tố "còn thiếu", Mendeleev cho thấy sự tán tưởng và biết ơn của mình với các nhà ngữ pháp tiếng Phạn của Ấn Độ cổ đại, những người đã tạo ra các lý thuyết phức tạp về ngôn ngữ dựa trên việc khám phá ra hai mô hình hai chiều của họ trong các âm cơ bản. Theo Giáo sư Paul Kiparsky thuộc Đại học Stanford, Mendeleev là một người bạn của chuyên gia tiếng Phạn Böhtlingk, người đang chuẩn bị cho ấn bản thứ hai của cuốn sách của mình về Pānini[11] ở khoảng thời gian đó, và Mendeleev muốn vinh danh Pānini với sự đặt tên của mình.[12] Lưu ý thấy có những sự tương tự đáng chú ý giữa Bảng tuần hoàn và đoạn mở đầu của ngữ pháp Panini, Giáo sư Kiparsky nói:
Trong một nỗ lực trong một quan niệm hoá học về Ête, ông đã đưa ra những lý thuyết rằng có sự tồn tại của hai nguyên tố hoá học trơ với trọng lượng nguyên tử nhỏ hơn hydro. Trong hai nguyên tố đề xuất đó, ông cho rằng nguyên tố nhẹ hơn là một loại khí có khả năng xâm nhập mọi nơi và hiện diện ở khắp nơi, và nguyên tố hơi nặng hơn là một nguyên tố đề xuất, coronium.
Mendeleev dành hầu hết việc nghên cứu của mình và có những đóng góp quan trọng cho việc xác định bản chất của những thành phần vô hạn như các dung dịch.
Trong một lĩnh vực khác của vật lý hoá học, ông đã nghiên cứu sự nở rộng của các chất lỏng với nhiệt độ, và phát minh một công thức tương tự như định luật Gay-Lussac về sự đồng nhất của sự nở rộng của các khí, trong khi ngay từ năm 1861 ông đã đoán trước quan niệm của Thomas Andrews về nhiệt độ tới hạn của các khí bằng các định nghĩa điểm sôi tuyệt đối của một vật chất khi nhiệt độ mà ở đó sự liên kết và nhiệt của sự bay hơi trở nên bằng không và dung dịch chuyển thành hơi, không cần biết tới áp suất và thể tích.
Mendeleev được coi là người đưa hệ mét vào sử dụng tại Đế quốc Nga.
Ông đã phát minh ra pyrocollodion, một kiểu bột không khói dựa trên nitrocellulose. Công trình này do Hải quân Nga đặt hàng, tuy nhiên không được chấp nhận sử dụng. Năm 1892 Mendeleev đã tổ chức việc sản xuất nó.
Mendeleev đã nghiên cứu nguồn gốc dầu mỏ và kết luận rằng các hydrocarbon là tự sinh và hình thành ở sâu bên trong quả đất. Ông viết: "Thực tế chính yếu cần lưu ý là dầu hoả sinh ra ở sâu trong quả đất, và chỉ tại đó chúng ta tìm kiếm nguồn gốc của nó." (Dmitri Mendeleev, 1877)[14]
Dmitri Ivanovich Mendeleev
Bách khoa toàn thư mở Wikipedia
| Dmitri Mendeleev | |
|---|---|

Dmitri Mendeleev in 1897
|
|
| Sinh | 8 tháng 2, 1834 |
| Mất | 2 tháng 2, 1907 (72 tuổi) |
| Quốc tịch | Người Nga |
| Tôn giáo | Cơ đốc giáo Chính thống phương Đông |
| Ngành | Nhà hoá học, vật lý và các lĩnh vực liên quan |
| Học trường | Đại học Saint Petersburg |
| Sinh viên đáng chú ý | Dmitri Konovalov, Gemilian, Valery, Baykov, Alexander |
| Nổi tiếng vì | Phát minh Bảng tuần hoàn các nguyên tố hoá học |
| Giải thưởng | Giải Demidov (1862) |
Mục lục
Cuộc đời
Mendeleev sinh tại làng Verhnie Aremzyani, gần Tobolsk, là con của Ivan Pavlovich Mendeleev và Maria Dmitrievna Mendeleeva (tên khi sinh Kornilieva). Ông bà ông là Pavel Maximovich Sokolov, một tu sĩ thuộc Nhà thờ Chính thống Nga từ vùng Tver.[1] Ivan, cùng với các anh chị em, đã có họ mới khi tham gia trường dòng thần học.[2]Mendeleev được cho là con út trong số 14 anh chị em, nhưng con số chính xác khác biệt tuỳ theo từng nguồn tin.[3] Khi 13 tuổi, sau khi cha ông qua đời và nhà máy của mẹ bị phá huỷ bởi hoả hoạn, Mendeleev theo học trung học tại Tobolsk.
Năm 1849, khi ấy gia đình Mendeleev đã nghèo túng chuyển tới Saint Petersburg, nơi ông vào Viện Sư phạm Main năm 1850. Sau khi tốt nghiệp, bệnh lao khiến ông phải chuyển tới Bán đảo Krym ở bờ biển phía bắc của Hắc Hải năm 1855. Tại đây ông trở thành một giáo viên khoa học tại Trường trung học số 1 Simferopol. Ông trở lại Saint Petersburg với sức khoẻ đã phục hồi hoàn toàn năm 1857.
Giai đoạn 1859 và 1861, ông làm việc về tính mao dẫn của các chất lỏng và kính quang phổ tại Heidelberg. Cuối tháng 8 năm 1861 ông viết cuốn sách đầu tiên về kính quang phổ. Ngày 4 tháng 4 năm 1862 ông hứa hôn với Feozva Nikitichna Leshcheva, và họ cưới ngày 27 tháng 4 năm 1862 tại nhà thờ của Trường Cao đẳng Cơ khí Nikolaev ở Saint Petersburg.[4] Mendeleev trở thành Giáo sư Hoá học tại Viện Công nghệ Nhà nước Saint Petersburg và Đại học Nhà nước Saint Petersburg năm 1863. Năm 1865 ông trở thành Tiến sĩ Khoa học với luận văn "Về những hoá hợp của Nước và Rượu". Ông được bổ nhiệm năm 1867, và tới năm 1871 đã biến Saint Petersburg thành một trung tâm được quốc tế công nhận trong lĩnh vực nghiên cứu hoá học. Năm 1876, ông say mê Anna Ivanova Popova và bắt đầu tán tỉnh bà, năm 1881 ông cầu hôn bà và đe doạ sẽ tự tử nếu bị từ chối. Cuộc li dị của ông với Leshcheva kết thúc một tháng sau khi ông đã cưới (ngày 2 tháng 4[5]) đầu năm 1882. Thậm chí sau khi li dị, Mendeleev về kỹ thuật vẫn là một người mắc tội lấy một người khác khi vẫn con trong hôn nhân; Nhà thờ Chính thống Nga yêu cầu phải có ít nhất 7 năm trước khi tái hôn một cách hợp pháp. Cuộc hôn nhân của ông và sự tranh cãi xung quanh nó góp phần khiến ông không thể được chấp nhận vào Viện Hàn lâm Khoa học Nga (dù danh tiếng quốc tế của ông vào thời điểm đó). Con gái ông từ cuộc hôn nhân thứ hai, trở thành vợ của nhà thơ Nga nổi tiếng Alexander Blok. Những người con khác của ông là con trai Vladimir (một thuỷ thủ, ông tham gia vào Chuyến đi về phía Đông của Nicholas II nổi tiếng) và con gái Olga, từ cuộc hôn nhân đầu tiên với Feozva, và con trai Ivan và một cặp sinh đôi với Anna.
Dù Mendeleev được các tổ chức khoa học trên khắp châu Âu ca tụng, gồm cả Huy chương Copley từ Viện Hoàng gia London, ông đã từ chức khỏi Đại học Saint Petersburg ngày 17 tháng 8 năm 1890.
Năm 1893, ông được chỉ định làm Giám đốc Phòng Cân và Đo lường. Chính trong vai trò này ông đã được giao trách nhiệm hình thành những tiêu chuẩn nhà nước mới cho việc sản xuất vodka. Nhờ công việc của ông, năm 1894 các tiêu chuẩn mới cho vodka được đưa vào trong luật Nga và mọi loại vodka phải được sản xuất với nồng độ 40% cồn.[6]
Mendeleev cũng nghiên cứu thành phần của các giếng dầu, và giúp thành lập nhà máy lọc dầu đầu tiên tại Nga.
Năm 1905, Mendeleev được bầu làm một thành viên của Viện Hàn lâm Khoa học Hoàng gia Thuỵ Điển. Năm sau Hội đồng Nobel Hoá học đã đề xuất với Viện Hàn lâm Thuỵ Điển trao Giải Nobel Hoá học năm 1906 cho Mendeleev vì phát minh ra bảng tuần hoàn của ông. Ban Hoá học của Viện Hàn lâm Thuỵ Điển đã ủng hộ đề xuất này. Viện Hàn lâm sau đó dường như đã ủng hộ lựa chọn của Uỷ ban như họ đã làm trong hầu hết mọi trường hợp. Không may thay, tại cuộc họp toàn thể của Viện, một thành viên bất mãn của Uỷ ban Nobel, Peter Klason, đề xuất tư cách ứng cử viên cho Henri Moissan người được ông ưa thích. Svante Arrhenius, dù không phải là một thành viên của Uỷ ban Nobel Hoá học, có rất nhiều ảnh hưởng trong Viện và cũng gây sức ép để loại bỏ Mendeleev, cho rằng bảng tuần hoàn quá cũ để được công nhận sự khám phá ra nó vào năm 1906. Theo những người thời đó, Arrhenius có động cơ từ sự đố kỵ của ông với Mendeleev vì Mendeleev chỉ trích lý thuyết phân ly của Arrhenius. Sau những cuộc tranh cãi nảy lửa, đa số thành viên Viện Hàn lâm bỏ phiếu cho Moissan. Những nỗ lực để đề cử Mendeleev năm 1907 một lần nữa không thành công bởi sự phản đối kịch liệt của Arrhenius.[7]
Năm 1907, Mendeleev mất ở tuổi 72 tại Saint Petersburg vì bệnh cúm. Miệng núi lửa Mendeleev trên Mặt trăng, cũng như nguyên tố số 101, chất phóng xạ mendelevium, được đặt theo tên ông.
Bảng tuần hoàn
Sau khi trở thành một giáo viên, Mendeleev đã viết cuốn sách hai tập cuối cùng ở thời điểm đó: Principles of Chemistry (Các nguyên tắc của Hoá học) (1868-1870). Khi ông tìm cách sắp xếp các nguyên tố theo các tính chất hoá học của chúng, ông nhận thấy các mẫu hình dẫn ông tới ý tưởng Bảng tuần hoàn. Mendeleev không hề biết về các công trình khác với các bảng tuần hoàn khác đang diễn ra trong thập niên 1860. Ông đã làm bảng sau, và bằng cách thêm các nguyên tố thêm theo mô hình này, phát triển phiên bản mở rộng của bảng tuần hoàn.[8][9]
| Cl 35.5 | K 39 | Ca 40 |
| Br 80 | Rb 85 | Sr 88 |
| I 127 | Cs 133 | Ba 137 |
- Các nguyên tố hoá học, nếu được sắp xếp theo trọng lượng nguyên tử, sẽ có một tính tuần hoàn rõ ràng trong tính chất.
- Các nguyên tố tương tự về tính chất hoá học có các trọng lượng nguyên tử hoặc hầu như có cùng giá trị (ví dụ, Pt, Ir, Os) hoặc tăng đều (ví dụ, K, Rb, Cs).
- Việc sắp xếp các nguyên tố thành các nhóm nguyên tố theo trật tự trọng lượng nguyên tử của chúng tương ứng với cái gọi là các hoá trị của chúng, cũng như, ở một số mức độ, với các tính chất hoá học riêng biệt của chúng; như thể hiện rõ trong các loạt nguyên tố i, Be, B, C, N, O, và F.
- Các nguyên tố có mật độ lớn nhất có trọng lượng nguyên tử nhó nhất.
- Tầm mức trọng lượng nguyên tử xác định tính chất nguyên tố, giống như tầm mức phân tử xác định tính chất của một thành phần hợp chất.
- Chúng ta phải đợi sự phát hiện của nhiều nguyên tố vẫn còn chưa được biết tới–ví dụ, hai nguyên tố, tương tự nhôm và silic, những nguyên tố có trọng lượng nguyên tử trong khoảng 65 và 75.
- Trọng lượng nguyên tử của một nguyên tố có thể thỉnh thoảng được sửa đổi theo sự hiểu biết những nguyên tố tiếp giáp của nó. Vì thế trọng lượng nguyên tử của tellurium phải nằm trong khoảng giữa 123 và 126, và không thể là 128. Ở đây Mendeleev đã sai bởi khối lượng nguyên tử của (127.6) vẫn cao hơn khối lượng nguyên tử của iodine (126.9).
- Một số tính chất đặc trưng của các nguyên tố có thể dự đoán trước từ trọng lượng nguyên tử của nó.
Về tám nguyên tố do ông dự đoán, ông đã sử dụng các hậu tố eka, dvi, và tri (tiếng Phạn một, hai, ba) trong việc đặt tên chúng. Mendeleev đã nghi ngờ một số trọng lượng nguyên tử hiện đã được chấp nhận (chúng chỉ có thể được đo với một độ chính xác khá thấp ở thời điểm đó), chỉ ra rằng chúng không tương ứng với những tính chất do Bảng tuần hoàn của ông chỉ ra. Ông lưu ý rằng tellurium có trọng lượng nguyên tử lớn hơn iodine, nhưng ông đặt nó vào trật tự đúng, dự đoán không chính xác rằng những trọng lượng nguyên tử đã được chấp nhận ở thời điểm đó là sai. Ông đã gặp khó xử khi tìm nơi đặt các lanthanide đã biết, và dự đoán sự tồn tại của hàng khác trong bảng là nơi đặt các actinide có một trong số các khối lượng nguyên tử nặng nhất. Một số người không chấp nhận việc Mendeleev dự đoán rằng sẽ còn có các nguyên tố khác, nhưng đã bị chứng minh là sai lầm khi Ga (gallium) và Ge (germanium) được tìm ra năm 1875 và 1886, trùng khớp một cách chính xác vào hai khoảng trống.[10]
Bằng cách đặt những cái tên tiếng Phạn cho các nguyên tố "còn thiếu", Mendeleev cho thấy sự tán tưởng và biết ơn của mình với các nhà ngữ pháp tiếng Phạn của Ấn Độ cổ đại, những người đã tạo ra các lý thuyết phức tạp về ngôn ngữ dựa trên việc khám phá ra hai mô hình hai chiều của họ trong các âm cơ bản. Theo Giáo sư Paul Kiparsky thuộc Đại học Stanford, Mendeleev là một người bạn của chuyên gia tiếng Phạn Böhtlingk, người đang chuẩn bị cho ấn bản thứ hai của cuốn sách của mình về Pānini[11] ở khoảng thời gian đó, và Mendeleev muốn vinh danh Pānini với sự đặt tên của mình.[12] Lưu ý thấy có những sự tương tự đáng chú ý giữa Bảng tuần hoàn và đoạn mở đầu của ngữ pháp Panini, Giáo sư Kiparsky nói:
[S]ự tương tự giữa hai hệ thống rất đáng chú ý. Bởi khi Panini thấy rằng các mô hình âm vị của âm thanh trong ngôn ngữ là một chức năng của các tính chất phát âm của chính, vì thế Mendeleev thấy rằng các tính chất hoá học của các nguyên tố là một chức năng của các trọng lượng nguyên tử của chúng. Giống như Panini, Mendeleev đã đạt tới phát minh của mình thông qua một sự nghiên cứu "ngữ pháp" của các nguyên tố...[13]
Các thành tựu khác
Mendeleev cũng có những đóng góp quan trọng khác cho hoá học. Nhà hoá học và lịch sử khoa học Nga L.A. Tchugayev đã coi ông là "một nhà hoá học thiên tài, nhà vật lý hàng đầu, một nhà nghiên cứu nhiều thành quả trong các lĩnh vực thuỷ động lực học, khí tượng học, địa chất học, một số nhánh của công nghệ hoá học (ví dụ chất nổ, hoá dầu, và nhiên liệu) và những ngành khác gần với hoá học và vật lý, một chuyên gia tinh thông về công nghiệp hoá học và công nghiệp nói chung, và một nhà tư tưởng độc đáo trong lĩnh vực kinh tế." Mendeleev là một trong những người sáng lập, năm 1869, Viện Hoá học Nga. Ông đã làm việc về lý thuyết và thực hành chủ nghĩa bảo hộ thương mại và về nông nghiệp.Trong một nỗ lực trong một quan niệm hoá học về Ête, ông đã đưa ra những lý thuyết rằng có sự tồn tại của hai nguyên tố hoá học trơ với trọng lượng nguyên tử nhỏ hơn hydro. Trong hai nguyên tố đề xuất đó, ông cho rằng nguyên tố nhẹ hơn là một loại khí có khả năng xâm nhập mọi nơi và hiện diện ở khắp nơi, và nguyên tố hơi nặng hơn là một nguyên tố đề xuất, coronium.
Mendeleev dành hầu hết việc nghên cứu của mình và có những đóng góp quan trọng cho việc xác định bản chất của những thành phần vô hạn như các dung dịch.
Trong một lĩnh vực khác của vật lý hoá học, ông đã nghiên cứu sự nở rộng của các chất lỏng với nhiệt độ, và phát minh một công thức tương tự như định luật Gay-Lussac về sự đồng nhất của sự nở rộng của các khí, trong khi ngay từ năm 1861 ông đã đoán trước quan niệm của Thomas Andrews về nhiệt độ tới hạn của các khí bằng các định nghĩa điểm sôi tuyệt đối của một vật chất khi nhiệt độ mà ở đó sự liên kết và nhiệt của sự bay hơi trở nên bằng không và dung dịch chuyển thành hơi, không cần biết tới áp suất và thể tích.
Mendeleev được coi là người đưa hệ mét vào sử dụng tại Đế quốc Nga.
Ông đã phát minh ra pyrocollodion, một kiểu bột không khói dựa trên nitrocellulose. Công trình này do Hải quân Nga đặt hàng, tuy nhiên không được chấp nhận sử dụng. Năm 1892 Mendeleev đã tổ chức việc sản xuất nó.
Mendeleev đã nghiên cứu nguồn gốc dầu mỏ và kết luận rằng các hydrocarbon là tự sinh và hình thành ở sâu bên trong quả đất. Ông viết: "Thực tế chính yếu cần lưu ý là dầu hoả sinh ra ở sâu trong quả đất, và chỉ tại đó chúng ta tìm kiếm nguồn gốc của nó." (Dmitri Mendeleev, 1877)[14]
Xem thêm
Tham khảo
- ^ Dmitriy Mendeleev: A Short CV, and A Story of Life
- ^ Удомельские корни Дмитрия Ивановича Менделеева (1834-1907)
- ^ Số lượng anh chị em của Mendeleev là chủ đề của một số cuộc tranh cãi lịch sử.
- ^ rustest.spb.ru
- ^ gazeta.ua
- ^ http://www.russianfoods.com/cuisine/article00016/default.asp
- ^ Friedman, Robert M. (2001). The politics of excellence: behind the Nobel Prize in science. New York: Times Books. tr. 32–34. ISBN 0-7167-3103-7.
- ^ A brief history of the development of the period table
- ^ Mendeleev and the Periodic Table
- ^ Emsley, John (2001). Nature's Building Blocks . Oxford University Press. tr. 521–522. ISBN 0198503407.
- ^ Otto Böhtlingk, Panini’s Grammatik: Herausgegeben, Ubersetzt, Erlautert und MIT Verschiedenen Indices Versehe. St. Petersburg, 1839-40.
- ^ Paul Kiparsky, “Economy and the construction of the Sivasutras.” In M. M. Deshpande and S. Bhate (eds.), Paninian Studies. Ann Arbor, Michigan, 1991.
- ^ Dr. Subhash Kak (Sandhan, vol 4, no 2, pp. 115-123, 2004). “Mendeleev and the Periodic Table of Elements”.
- ^ Mendeleev, D., 1877. L'Origine du pétrole. Revue Scientifique, 2e Ser., VIII, p. 409-416.
Đọc thêm
- Gordin, Michael (2004). A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. New York: Basic Books. ISBN 0-465-02775-X.
- Mendeleyev, Dmitry Ivanovich; Jensen, William B. (2005). Mendeleev on the Periodic Law: Selected Writings, 1869 - 1905. Mineola, NY: Dover. ISBN 0-486-44571-2.
- Strathern, Paul (2001). Mendeleyev's Dream: The Quest For the Elements. New York: St. Martins Press.
- Mendeleev, Dmitrii Ivanovich (1901). Principles of Chemistry. New York: Collier.
Liên kết ngoài
| Wikimedia Commons có thêm thể loại hình ảnh và tài liệu về Dmitri Mendeleev |
Tiểu sử
- Roger Rumppe và Michael E. Sixtus, "Ich bin Mendelejeff", care of the Woodrow Wilson Leadership Program in Chemistry. 20 sources. Notes, among other things, that various sources list D.M.'s siblings as being 10 to 16 in number.
Bảng tuần hoàn
- Original Periodic Table, annotated
- Mendeleev's first draft version of the Periodic Table, 17 tháng 2 năm 1869
Khác
- References about Mendeleev, maintained by Eugene V. Babaev, cập nhật lần cuối tháng 5 năm 2005 (vào tháng 12 năm 2005).
- Faraday Lecture by Mendeleev, 4 tháng 7 năm 1889, annotated
- Mendeleev and Sanskrit
- Picture of Mendeleev, Edgar Fahs Smith Collection, University of Pennsylvania
- Everything in its Place
- Mendeleev profile at thinkquest.org
- Dmitri Ivanovich Mendeleev article on h2g2.
- Who was Dmitri Mendeleev?
Thể loại:
Hiệp định sơ bộ Pháp-Việt là một hiệp định được ký ngày 6 tháng 3 năm 1946 giữa Pháp và Việt Nam Dân chủ Cộng hòa. Hiệp định này được xem là một nước cờ chính trị của cả hai bên nhằm mưu đồ lợi ích riêng.
Theo thỏa thuận của các nước Đồng Minh, quân đội Trung Hoa Quốc dân đảng tiến vào miền Bắc Việt Nam để làm nhiệm vụ giải giáp quân đội Đế quốc Nhật Bản. Ở miền Nam Việt Nam, quân Anh tiến vào với nhiệm vụ tương tự. Tuy người Việt Nam đã tự thành lập chính quyền và tuyên bố độc lập, chính phủ Pháp vẫn quyết tâm tái lập quyền cai trị Đông Dương.
Rạng ngày 23 tháng 9 năm 1945, người Pháp, dưới sự giúp đỡ của quân đội Anh, đã dùng vũ lực buộc Lâm ủy Nam Bộ phải giải tán, giao lại chính quyền cho người Pháp. Tuy nhiên, chính quyền người Việt đã thực hiện cuộc chiến tranh du kích để chống lại.
Ở miền Bắc, quân đội Trung Hoa Quốc dân đảng vẫn công nhận chính phủ Việt Nam Dân chủ Cộng hòa cho mưu đồ chính trị của họ. Tuy nhiên, người Pháp cũng đã thương lượng với chính phủ Trung Hoa Quốc dân đảng để đưa quân đội xâm nhập Bắc Việt Nam.
Ngày 28 tháng 2 năm 1946, Hiệp ước Hoa–Pháp được ký kết, với 2 điểm chính:
Ngày 6 tháng 3 năm 1946, Hiệp định sơ bộ Pháp-Việt được ký kết giữa Jean Sainteny, đại diện chính phủ Cộng hòa Pháp, và Hồ Chí Minh cùng Vũ Hồng Khanh, đại diện chính phủ Việt Nam Dân chủ Cộng hòa. Nội dung của Hiệp định bao gồm các điểm chính sau đây:[1]
Về phía Việt Minh, quân Trung Hoa được xác định là nguy cơ lớn nhất. Để loại trừ nguy cơ của 20 vạn quân Trung Hoa chiếm đóng, tránh được tình thế bất lợi "phải cô lập chiến đấu cùng một lúc với nhiều lực lượng phản động (thực dân Pháp, Tàu trắng, bọn phản cách mạng trong nước)"[2], tập trung đối phó với người Pháp và "các đảng phái phản động"[2]. Đồng thời, tranh thủ được thời gian hòa hoãn quý báu để "Bảo toàn thực lực giành lấy giây phút nghỉ ngơi và củng cố vị trí mới đã chiếm được, chấn chỉnh đội ngũ cách mạng, bổ sung cán bộ, bồi dưỡng và củng cố phong trào".[2] Một số thành viên trong Chính phủ Liên hiệp thuộc lực lượng Việt Quốc, Việt Cách không tán thành việc này lên tiếng phản đối gây ra bất đồng sâu sắc, dân chúng cũng có người băn khoăn, nhưng Chủ tịch Hồ Chí Minh đã bình tĩnh giải thích và động viên đồng bào để đồng bào hiểu rõ "cần phải biết chịu đựng hy sinh để mưu sự nghiệp lớn".[3]. Mặc dù Hiệp định có chữ ký của Vũ Hồng Khanh nhưng đa số lãnh đạo Việt Quốc rút sự ủng hộ của họ cho chính phủ Hồ Chí Minh để phản đối, chống lại những gì họ gọi là "thân Pháp" trong chính sách của Việt Minh. Bảo Đại rời khỏi đất nước vào ngày 18 tháng 3, ngày quân Pháp vào Hà Nội. Một hội nghị liên tịch được tổ chức để khai thông các bất đồng dẫn đến việc thành lập Hội Liên hiệp Quốc dân Việt Nam[4].
Sau khi ký Hiệp định sơ bộ Pháp-Việt, hai bên Việt-Pháp tiếp tục xúc tiến hội đàm tại Hội nghị Đà Lạt và Hội nghị Fontainebleau để đàm phán về nền độc lập của Việt Nam trong Liên hiệp Pháp và việc thống nhất Việt Nam. Leclerc, tổng chỉ huy Pháp ở Đông Dương khi đề nghị đàm phán đã bị chuẩn tướng Charles de Gaulle trách móc: “Nếu tôi mà đồng ý mấy thứ nhảm nhí này thì đế quốc Pháp đã tiêu vong lâu rồi. Hãy đọc thật kỹ câu chữ trong tuyên bố tháng 3 của Pháp về Đông dương”.[5]
Tuy nhiên, hiệp định đã bị Cao ủy Đông Dương, Georges Thierry d'Argenlieu, làm mất giá trị khi ông tuyên bố chấp nhận sự thành lập Nam Kỳ quốc tại Sài Gòn vào ngày 1 tháng 6 cùng năm trong lúc Hội nghị Fontainebleau đang diễn ra.
Trong lúc đó, Võ Nguyên Giáp vội vã từng bước tìm cách loại bỏ dần các đảng phái đối lập như Việt Quốc, Việt Cách, Đại Việt, những người Trotskist, lực lượng chính trị Công giáo... Ngày 19/6/1946, Báo Cứu Quốc của Tổng bộ Việt Minh đăng xã luận kịch liệt chỉ trích "bọn phản động phá hoại Hiệp định sơ bộ Pháp Việt mùng 6 tháng 3". Ngay sau đó Võ Nguyên Giáp bắt đầu chiến dịch truy quét các đảng phái đối lập bằng lực lượng công an và quân đội do Việt Minh kiểm soát với sự giúp đỡ của nhà cầm quyền Pháp. Ông cũng sử dụng các sỹ quan Nhật Bản trốn tại Việt Nam và một số vũ khí do Pháp cung cấp cho chiến dịch này.[6] Một trong những sự kiện nổi tiếng nhất trong chiến dịch tiêu diệt các đảng phái đối lập là vụ án phố Ôn Như Hầu.
- Sinh 1834
- Mất 1907
- Người Tyumen Oblast
- Nhà hóa học Nga
- Nhà hóa học vô cơ
- Nhà khoa học Nga
- Thành viên Viện Hàn lâm Khoa học Thuỵ Điển
- Thành viên Viện Hàn lâm Khoa học Nga
- Thành viên Viện Hàn lâm Khoa học Hoàng gia Thuỵ Điển
- Người theo học Đại học Nhà nước Saint Petersburg
- Nhà phát minh Nga
- Người được nhận Huy chương Copley
- Người theo học Viện Công nghệ Saint Petersburg
- Người được nhận Giải Demidov
- Người theo chủ nghĩa quân chủ Nga
- Tín đồ Cơ đốc giáo Chính thống phía Đông Nga
Hiệp định sơ bộ Pháp-Việt (1946)
Bách khoa toàn thư mở Wikipedia
|
||
Hiệp định sơ bộ Pháp-Việt là một hiệp định được ký ngày 6 tháng 3 năm 1946 giữa Pháp và Việt Nam Dân chủ Cộng hòa. Hiệp định này được xem là một nước cờ chính trị của cả hai bên nhằm mưu đồ lợi ích riêng.
Mục lục
Nguyên nhân
Sau cuộc đảo chính của Nhật ngày 9 tháng 3 năm 1945, thực dân Pháp mất quyền cai trị Liên bang Đông Dương. Tuy nhiên, sau khi Nhật đầu hàng khối Đồng Minh, Việt Minh chớp thời cơ giành chính quyền từ tay Đế quốc Việt Nam được Đế quốc Nhật Bản bảo hộ, nhanh chóng kiểm soát đất nước, và thành lập chính phủ Việt Nam Dân chủ Cộng hòa vào ngày 2 tháng 9 năm 1945.Theo thỏa thuận của các nước Đồng Minh, quân đội Trung Hoa Quốc dân đảng tiến vào miền Bắc Việt Nam để làm nhiệm vụ giải giáp quân đội Đế quốc Nhật Bản. Ở miền Nam Việt Nam, quân Anh tiến vào với nhiệm vụ tương tự. Tuy người Việt Nam đã tự thành lập chính quyền và tuyên bố độc lập, chính phủ Pháp vẫn quyết tâm tái lập quyền cai trị Đông Dương.
Rạng ngày 23 tháng 9 năm 1945, người Pháp, dưới sự giúp đỡ của quân đội Anh, đã dùng vũ lực buộc Lâm ủy Nam Bộ phải giải tán, giao lại chính quyền cho người Pháp. Tuy nhiên, chính quyền người Việt đã thực hiện cuộc chiến tranh du kích để chống lại.
Ở miền Bắc, quân đội Trung Hoa Quốc dân đảng vẫn công nhận chính phủ Việt Nam Dân chủ Cộng hòa cho mưu đồ chính trị của họ. Tuy nhiên, người Pháp cũng đã thương lượng với chính phủ Trung Hoa Quốc dân đảng để đưa quân đội xâm nhập Bắc Việt Nam.
Ngày 28 tháng 2 năm 1946, Hiệp ước Hoa–Pháp được ký kết, với 2 điểm chính:
- Pháp trả lại các tô giới và nhượng địa của Pháp trên đất Trung Quốc như Quảng Châu Loan và nhượng cho Trung Hoa một số quyền lợi tại miền Bắc Việt Nam như cho họ khai thác một đặc khu tại hải cảng Hải Phòng, miễn thuế cho hàng hóa của Trung Hoa vận chuyển sang miền Bắc Việt Nam.
- Ngược lại chính phủ Trung Hoa Quốc dân đảng đồng ý cho Pháp thay thế quân Trung Hoa giải giáp quân Nhật tại miền Bắc Việt Nam.
Hiệp định sơ bộ Pháp-Việt
Trong thời gian đầu, Chính phủ Việt Nam Dân chủ Cộng hòa gồm nhiều thành phần kiên quyết chống lại việc Pháp tái lập chủ quyền ở Đông Dương. Nhưng sau đó những thành viên Chính phủ là đảng viên Đảng cộng sản Đông Dương thay đổi ý kiến muốn ký kết Hiệp định với Pháp. Theo quan điểm của Ban Thường vụ TW 3 Đảng cộng sản Đông Dương (đã lui vào hoạt động bí mật), tháng 3 năm 1946, nếu Pháp cho Đông Dương tự trị theo tuyên bố ngày 24 tháng 3 năm 1945 thì kiên quyết đánh, nhưng nếu cho Đông Dương tự chủ thì hòa để phá tan âm mưu của "bọn Tàu trắng, bọn phản động Việt Nam và bọn phát xít Nhật còn lại".Ngày 6 tháng 3 năm 1946, Hiệp định sơ bộ Pháp-Việt được ký kết giữa Jean Sainteny, đại diện chính phủ Cộng hòa Pháp, và Hồ Chí Minh cùng Vũ Hồng Khanh, đại diện chính phủ Việt Nam Dân chủ Cộng hòa. Nội dung của Hiệp định bao gồm các điểm chính sau đây:[1]
- Chính phủ Pháp công nhận nước Việt Nam Dân chủ Cộng hòa là một quốc gia tự do trong Liên bang Đông Dương và trong khối Liên hiệp Pháp, có chính phủ, nghị viện, quân đội và tài chính riêng
- Chính phủ Việt Nam Dân chủ Cộng hòa đồng ý cho 15.000 quân Pháp vào miền Bắc thay thế cho 200.000 quân Trung Hoa Quốc dân đảng để làm nhiệm vụ giải giáp quân Nhật. Pháp hứa sẽ rút hết quân trong thời hạn 5 năm, mỗi năm rút 3.000 quân.
- Pháp đồng ý thực hiện trưng cầu dân ý tại Nam Kỳ về việc thống nhất với Việt Nam Dân chủ Cộng hòa.
- Hai bên thực hiện ngưng bắn, giữ nguyên quân đội tại vị trí hiện thời để đàm phán về chế độ tương lai của Đông Dương, quan hệ ngoại giao giữa Việt Nam Dân chủ Cộng hòa và nước ngoài và những quyền lợi kinh tế và văn hóa của Pháp ở Việt Nam.
Về phía Việt Minh, quân Trung Hoa được xác định là nguy cơ lớn nhất. Để loại trừ nguy cơ của 20 vạn quân Trung Hoa chiếm đóng, tránh được tình thế bất lợi "phải cô lập chiến đấu cùng một lúc với nhiều lực lượng phản động (thực dân Pháp, Tàu trắng, bọn phản cách mạng trong nước)"[2], tập trung đối phó với người Pháp và "các đảng phái phản động"[2]. Đồng thời, tranh thủ được thời gian hòa hoãn quý báu để "Bảo toàn thực lực giành lấy giây phút nghỉ ngơi và củng cố vị trí mới đã chiếm được, chấn chỉnh đội ngũ cách mạng, bổ sung cán bộ, bồi dưỡng và củng cố phong trào".[2] Một số thành viên trong Chính phủ Liên hiệp thuộc lực lượng Việt Quốc, Việt Cách không tán thành việc này lên tiếng phản đối gây ra bất đồng sâu sắc, dân chúng cũng có người băn khoăn, nhưng Chủ tịch Hồ Chí Minh đã bình tĩnh giải thích và động viên đồng bào để đồng bào hiểu rõ "cần phải biết chịu đựng hy sinh để mưu sự nghiệp lớn".[3]. Mặc dù Hiệp định có chữ ký của Vũ Hồng Khanh nhưng đa số lãnh đạo Việt Quốc rút sự ủng hộ của họ cho chính phủ Hồ Chí Minh để phản đối, chống lại những gì họ gọi là "thân Pháp" trong chính sách của Việt Minh. Bảo Đại rời khỏi đất nước vào ngày 18 tháng 3, ngày quân Pháp vào Hà Nội. Một hội nghị liên tịch được tổ chức để khai thông các bất đồng dẫn đến việc thành lập Hội Liên hiệp Quốc dân Việt Nam[4].
Sau khi ký Hiệp định sơ bộ Pháp-Việt, hai bên Việt-Pháp tiếp tục xúc tiến hội đàm tại Hội nghị Đà Lạt và Hội nghị Fontainebleau để đàm phán về nền độc lập của Việt Nam trong Liên hiệp Pháp và việc thống nhất Việt Nam. Leclerc, tổng chỉ huy Pháp ở Đông Dương khi đề nghị đàm phán đã bị chuẩn tướng Charles de Gaulle trách móc: “Nếu tôi mà đồng ý mấy thứ nhảm nhí này thì đế quốc Pháp đã tiêu vong lâu rồi. Hãy đọc thật kỹ câu chữ trong tuyên bố tháng 3 của Pháp về Đông dương”.[5]
Tuy nhiên, hiệp định đã bị Cao ủy Đông Dương, Georges Thierry d'Argenlieu, làm mất giá trị khi ông tuyên bố chấp nhận sự thành lập Nam Kỳ quốc tại Sài Gòn vào ngày 1 tháng 6 cùng năm trong lúc Hội nghị Fontainebleau đang diễn ra.
Chính phủ Liên hiệp Kháng chiến tan rã
Ngày 15/6/1946, người lính cuối cùng của quân đội Trung Hoa Dân Quốc rời khỏi Việt Nam[6]. Các thành viên Việt Nam Quốc dân Đảng và Việt Nam Cách Mệnh Đồng minh hội mất chỗ dựa hậu thuẫn chính là quân đội Tưởng Giới Thạch và do bất đồng về việc ký Hiệp định sơ bộ Pháp-Việt mùng 6 tháng 3 đã lần lượt rút khỏi chính phủ Liên hiệp.[cần dẫn nguồn] Lãnh tụ đảng Việt Cách là Nguyễn Hải Thần và các thành viên Việt Quốc - Việt Cách khác trong chính phủ như Nguyễn Tường Tam, Vũ Hồng Khanh và cánh thân Tưởng do Vũ Hồng Khanh lãnh đạo lưu vong sang Trung Quốc. Các đảng viên Đại Việt phần lớn vẫn ở lại Việt Nam chờ thời cơ[7]. Nguyễn Tường Tam với tư cách Bộ trưởng Bộ ngoại giao dẫn đầu phái đoàn Việt Nam Dân chủ Cộng hòa tham gia Hội nghị trù bị tại Đà Lạt, nhưng do bất đồng đã không tham gia hầu hết các phiên họp[8], sau đó cũng không tham gia Hội nghị Fontainebleau, cuối cùng rời bỏ chính phủ[9] (tài liệu nhà nước nêu Nguyễn Tường Tam thiếu bản lĩnh chính trị, lập trường bấp bênh, biển thủ công quỹ rồi đào nhiệm sang nước ngoài[10]). Việc các thành viên chủ chốt của Việt Quốc, Việt Cách như Nguyễn Hải Thần, Nguyễn Tường Tam, Vũ Hồng Khanh rời bỏ chính phủ, lưu vong sang Trung Quốc đã đánh dấu chấm hết cho thời kỳ hợp tác giữa Việt Minh và các đảng phái không cộng sản tại miền Bắc, trong công cuộc "kháng chiến kiến quốc" mà Chính phủ Liên hiệp Kháng chiến là biểu tượng.Trong lúc đó, Võ Nguyên Giáp vội vã từng bước tìm cách loại bỏ dần các đảng phái đối lập như Việt Quốc, Việt Cách, Đại Việt, những người Trotskist, lực lượng chính trị Công giáo... Ngày 19/6/1946, Báo Cứu Quốc của Tổng bộ Việt Minh đăng xã luận kịch liệt chỉ trích "bọn phản động phá hoại Hiệp định sơ bộ Pháp Việt mùng 6 tháng 3". Ngay sau đó Võ Nguyên Giáp bắt đầu chiến dịch truy quét các đảng phái đối lập bằng lực lượng công an và quân đội do Việt Minh kiểm soát với sự giúp đỡ của nhà cầm quyền Pháp. Ông cũng sử dụng các sỹ quan Nhật Bản trốn tại Việt Nam và một số vũ khí do Pháp cung cấp cho chiến dịch này.[6] Một trong những sự kiện nổi tiếng nhất trong chiến dịch tiêu diệt các đảng phái đối lập là vụ án phố Ôn Như Hầu.
Tham khảo
- ^ Hồ Chí Minh. Toàn tập. Tập 4. NXB Chính trị Quốc gia. 2000. trang 324 - 326
- ^ a b c Chỉ thị của Ban Thường vụ Trung ương Đảng: Hoà để tiến, ngày 9-3-1946, Văn kiện Đảng toàn tập, online
- ^ Hiệp định Sơ bộ Việt - Pháp 6/3/1946- Một quyết định tài tình của Hồ Chí Minh và Đảng ta, Tạp chí của Ban Tuyên giáo Trung ương,15:39' 4/3/2011. Trích :"Tuy nhiên, khi biết tin Hiệp định sơ bộ được ký kết, dư luận các đảng phái quốc gia và thân nước ngoài như Việt Cách, Việt Quốc đã lên tiếng phản đối, nhân dân cũng còn chỗ băn khoăn ..."
- ^ United States – Vietnam Relations, 1945–1967: A Study Prepared by the Department of Defense/I. B
- ^ Hồ Chí Minh - A Life. Chương 12: Tái thiết và kháng chiến
- ^ a b Chiến thắng bằng mọi giá, trang 196-197, Cecil B. Currey, Nxb Thế Giới, 2013
- ^ Đại tướng Võ Nguyên Giáp - Tổng tập Hồi ký, Những năm tháng không thể nào quên, trang 290
- ^ Đại tướng Võ Nguyên Giáp, Tổng tập Hồi Ký, Những năm tháng không thể nào quên, trang 274
- ^ Việt Nam, một thế kỷ qua, Nguyễn Tường Bách, Nxb Thạch Ngữ, California, 1998
- ^ Bộ trưởng Nguyễn Tường Tam, Trang web Bộ Ngoại giao
Thư mục
- Spencer C. Tucker, Encyclopedia of the Vietnam War, ABC-CLIO, 2000. tr. 181-182. Mục "Hô-Sainteny Agreement".
Xem thêm
| Wikisource tiếng Việt có toàn văn tác phẩm về:
|
Thể loại:
Việt Nam Dân chủ Cộng hòa là một nhà nước ở vùng Đông Nam Á, được Chủ tịch Hồ Chí Minh tuyên bố thành lập ngày 2 tháng 9 năm 1945 tại Hà Nội. Nhà nước này khẳng định chủ quyền một cách xuyên suốt toàn bộ nước Việt Nam hiện nay theo các hiến pháp Việt Nam[1][2] được thông qua bởi Quốc hội Việt Nam khóa I, dù nhiều vùng lãnh thổ sau này bị quản lý thực tế bởi các nhà nước khác. Cuối cuộc Chiến tranh Đông Dương lần thứ nhất, Việt Nam bị chia làm hai vùng tập kết quân sự tạm thời theo Hiệp định Geneva. Từ năm 1954 đến năm 1976 là một nhà nước độc lập theo chủ nghĩa xã hội, quản lý thực tế miền Bắc Việt Nam. Sau năm 1976, Việt Nam Dân chủ Cộng hòa sát nhập với Cộng hòa Miền Nam Việt Nam thành một nhà nước thống nhất có tên gọi là Cộng hòa Xã hội Chủ nghĩa Việt Nam.
Trong Chiến tranh Thế giới II, Việt Nam là một thuộc địa của Pháp, nhưng lại nằm dưới sự chiếm đóng của Nhật Bản. Ngay sau khi Nhật Bản đầu hàng quân Đồng Minh và cuộc Cách mạng tháng 8 năm 1945 thành công, nước Việt Nam Dân chủ Cộng hòa được tuyên bố thành lập tại Hà Nội, chính quyền mới được thiết lập trên toàn bộ đất nước. Hồ Chí Minh người lãnh đạo Việt Minh, trở thành người đứng đầu chính phủ mới. Ngay sau khi Pháp quay trở lại Việt Nam năm 1945, thì cuộc Chiến tranh Đông Dương lần thứ nhất đã nổ ra vào năm 1946. Sau 9 năm chiến tranh, năm 1954 Hiệp định Geneva được ký kết giữa các bên tham chiến, Việt Nam bị chia làm 2 miền lấy vĩ tuyến 17 làm ranh giới. Việt Nam Dân chủ Cộng hòa là chính phủ ở miền Bắc Việt Nam, trong khi đó Quốc gia Việt Nam kiểm soát ở miền Nam Việt Nam.
Hiệp Định Geneva xác định cuộc tổng tuyển cử thống nhất 2 miền sẽ diễn ra vào năm 1956. Người Pháp chấp nhận đề nghị của thủ tướng Phạm Văn Đồng, trưởng phái đoàn đàm phán Việt Nam Dân chủ Cộng hòa[3], là cuộc tổng tuyển cử thống nhất sẽ được đặt dưới sự giám sát của các ủy ban tại chỗ.[4] Hoa Kỳ không công nhận Hiệp định Genève đồng thời thực hiện "Kế hoạch Hoa Kỳ" với sự ủng hộ từ phía Quốc gia Việt Nam và Vương quốc Anh, nhằm trợ giúp cho Quốc gia Việt Nam.[5]
Trong Chiến tranh Việt Nam (1955–1975), Việt Nam Dân Chủ Cộng hòa cùng các đồng minh ở phe Xã hội chủ nghĩa gồm cả Liên Xô và Trung Quốc đã chiến đấu chống lại quân đội của chính phủ Việt Nam Cộng hòa, Hoa Kỳ và các đồng minh gồm Australia, Hàn Quốc, Philippines, Thái Lan và các quốc gia khác. Ở thời điểm cao trào của cuộc chiến, Hoa Kỳ có tới 600.000 quân ở miền Nam Việt Nam. Đây là cuộc chiến tranh khốc liệt nhất trong thời kỳ Chiến tranh Lạnh, kéo dài 21 năm. Chiến tranh kết thúc với thắng lợi hoàn toàn của các lực lượng Cộng hòa Miền Nam Việt Nam dưới sự lãnh đạo của Đảng Lao động Việt Nam được Việt Nam Dân chủ cộng hòa hỗ trợ vào năm 1975. Hai nửa của Việt Nam (miền Bắc và miền Nam) đã thống nhất thành nước Cộng hoà xã hội chủ nghĩa Việt Nam vào năm 1976.
Ngày 13/8/1945, Hội nghị toàn quốc Đảng Cộng sản Đông Dương họp tại Tân Trào (Tuyên Quang) nhận định thời cơ khởi nghĩa vũ trang giành chính quyền đã đến đồng thời cử ra Ủy ban khởi nghĩa toàn quốc do Trường Chinh làm chủ tịch. Ðêm 13/8/1945, Ủy ban khởi nghĩa ra Quân lệnh số 1, kêu gọi toàn dân khởi nghĩa giành chính quyền.[6]
Ngày 16/8/1945, Việt Minh tổ chức Đại hội Quốc dân ở Tân Trào. Đại hội này thông qua 10 chính sách lớn của Việt Minh, thông qua Lệnh tổng khởi nghĩa, quyết định Quốc kỳ nền đỏ, ở giữa có sao vàng năm cánh, chọn bài Tiến quân ca làm Quốc ca và bầu ra Ủy ban Dân tộc Giải phóng Việt Nam, sau này trở thành Chính phủ Cách mạng Lâm thời, do Hồ Chí Minh làm Chủ tịch.[7]
Từ ngày 14/8/1946 một số cán bộ Đảng Cộng sản Đông Dương và Việt Minh dù chưa nhận được lệnh khởi nghĩa nhưng căn cứ vào tình hình hiện tại và chỉ thị "Nhật - Pháp bắn nhau và hành động của chúng ta" đã quyết định phát động nhân dân khởi nghĩa tại các tỉnh miền Bắc, miền Trung như Thanh Hóa, Thái Bình, Khánh Hòa ... buộc Đế quốc Việt Nam giao chính quyền cho nhân dân. Cuộc khởi nghĩa lan rộng ra khắp cả nước.[8][9][10]
Ngày 19/8/1945, Việt Minh tổ chức một cuộc mít tinh tại Quảng trường Nhà hát lớn Hà Nội. Đại diện Việt Minh tuyên bố: Tổng khởi nghĩa! Sau đó một cánh tiến thẳng tới Phủ Khâm Sai, cơ quan đầu não của chính phủ Đế quốc Việt Nam tại miền Bắc, và nhanh chóng làm chủ toàn bộ khu vực này. Lính bảo vệ Phủ đã hạ vũ khí mà không có bất kỳ hành động kháng cự nào. Khâm sai Bắc kỳ Nguyễn Xuân Chữ (người mới đứng ra thay thế ông Phan Kế Toại) bị bắt giữ và đưa về An toàn khu tại Hà Đông.[11]
Trong Cách mạng Tháng Tám, Đảng Cộng sản Đông Dương (tổ chức nòng cốt của Việt Minh) đóng vai trò chỉ đạo chung thống nhất, đưa ra các quyết sách tổ chức tổng khởi nghĩa giành chính quyền từ tay chính quyền Đế quốc Việt Nam thân Nhật và lực lượng quân đội đế quốc Nhật Bản, dù trên thực tế ở một số tỉnh thành chưa có hay khôi phục lại tổ chức đảng. Tại miền Bắc, một số tỉnh chưa có tổ chức đảng nhưng mặt trận Việt Minh hoạt động rất mạnh hầu khắp các tỉnh thành. Tại miền Trung, hoạt động của mặt trận Việt Minh và Đảng Cộng sản khá mạnh. Trong khi đó ở Nam Bộ, hoạt động của Việt Minh có phần yếu hơn, Đảng Cộng sản chưa khôi phục đầy đủ sau Nam Kỳ Khởi Nghĩa. Trong Cách mạng Tháng Tám, tổ chức Việt Minh đã thu hút được cả lực lượng Thanh niên tiền tuyến do Chính phủ Đế quốc Việt Nam thành lập gia nhập Mặt trận Việt Minh. Tại một số tỉnh Nam Bộ, Thanh niên tiền phong đóng vai trò quan trọng giành chính quyền.[12]
Ngày 25 tháng 8, 1945, Bảo Đại đọc Tuyên ngôn Thoái vị trước hàng ngàn người tụ họp trước cửa Ngọ Môn và sau đó trao ấn tín, quốc bảo của hoàng triều cho ông Trần Huy Liệu. Bảo Đại trở thành "công dân Vĩnh Thụy". Bản Tuyên ngôn Thoái vị có câu nói nổi tiếng "Trẫm muốn được làm Dân một nước tự do, hơn làm Vua một nước bị trị".[13]
Ngày 27 tháng 8, 1945, theo đề nghị của Hồ Chí Minh, Ủy ban Dân tộc Giải phóng Việt Nam được cải tổ thành Chính phủ Cách mạng Lâm thời nước Việt Nam Dân chủ Cộng hoà. Nhiều Ủy viên Việt Minh trong Ủy ban Dân tộc Giải phóng Việt Nam đã tự nguyện rút ra khỏi Chính phủ để mời thêm nhiều nhân sĩ ngoài Việt Minh tham gia.[7]
Việt Nam Dân chủ Cộng hòa được thành lập vào ngày 2 tháng 9 năm 1945 (đây cũng là ngày quốc khánh của nước Cộng hòa Xã hội Chủ nghĩa Việt Nam hiện nay), sau Cách mạng Tháng Tám dưới sự lãnh đạo của mặt trận Việt Minh.
Việt Nam Dân chủ Cộng hòa tiến hành bầu cử Quốc hội đầu tiên vào ngày 6 tháng Giêng năm 1946. Hiến pháp thông qua ngày 9 tháng 11. Trong giai đoạn đầu khi thành lập chính quyền toàn quốc, Việt Minh mà Đảng Cộng sản làm nòng cốt giữ vai trò lãnh đạo. Trong một thời gian ngắn chính quyền bao gồm nhiều tổ chức, đảng phái chính trị tham gia ở cấp trung ương và địa phương (Việt Quốc, Việt Cách, Đại Việt, Trốtxkit, Cao Đài, Hòa Hảo,...). Sau một thời gian vài năm hoạt động bí mật, Đảng Cộng sản ra hoạt động bán công khai trong tổ chức Việt Minh và Liên Việt, và từ năm 1951 hoạt động công khai chính thức giữ vai trò lãnh đạo Nhà nước. Tham gia chính quyền sau năm 1954 còn có Đảng Dân chủ và Đảng Xã hội trong Mặt trận Tổ quốc Việt Nam, do Đảng Lao động lãnh đạo.
Sau khi Nhật đảo chính Pháp và tuyên bố trao trả độc lập cho Việt Nam. Ngày 11 tháng 3 năm 1945, Bảo Đại ra đạo dụ "Tuyên cáo Việt Nam độc lập", tuyên bố hủy bỏ Hòa ước Patenôtre ký với Pháp năm 1884, khôi phục chủ quyền Việt Nam, thống nhất Bắc Kỳ, Trung Kỳ và Nam Kỳ.[14] Trong tuyên bố của Bảo Đại, bãi bỏ các hiệp ước bảo hộ và mất độc lập với Pháp trước đây, độc lập theo tuyên ngôn Đại đông Á, và "ông cũng như Chính phủ Việt Nam tin tưởng lòng trung thực của Nhật Bản và nó được xác định làm việc với các nước để đạt được mục đích".[cần dẫn nguồn]
Ngày 24 tháng 3, 1945, sau khi Nhật đảo chính Pháp tại Đông Dương, de Gaulle đã tuyên bố khẳng định chủ quyền Pháp tại Đông Dương, nhưng sẽ cho Đông Dương tự trị và thực thi tự do dân chủ với Hội đồng liên bang được thành lập với không quá 50% là người bản xứ.
Ngày 7 tháng 4 năm 1945, Bảo Đại đã ký đạo dụ số 5 chuẩn y thành phần nội các Trần Trọng Kim và ngày 12 tháng 5 giải thể Viện Dân biểu Trung Kỳ.[cần dẫn nguồn] Tháng 6 năm 1945, chính phủ Trần Trọng Kim đặt quốc hiệu là Đế quốc Việt Nam.
Ngày 16 tháng 8 năm 1945, Trần Trọng Kim tuyên bố bảo vệ "độc lập" giành được 9 tháng 3, và ngày 18 tháng 8 tạo ra một ủy ban giải phóng dân tộc, bao gồm tất cả các đảng phái chính trị để lãnh đạo việc giành lại độc lập cho Việt Nam.[cần dẫn nguồn] Theo lời khuyên của ông Bộ trưởng Bộ Ngoại giao, Bảo Đại gửi thông điệp cho Tổng thống Truman, vua nước Anh, Thống chế Tưởng Giới Thạch, Tướng de Gaulle đề nghị công nhận độc lập của Việt Nam. Tuy nhiên đến 24 tháng 8 ông đã thực hiện câu trả lời Hội đồng Cơ mật quyết định thoái vị "để không phải là một trở ngại cho sự giải phóng của đất nước".[15]
Ngày 18 tháng 8 năm 1945, vua Bảo Đại đã xác nhận độc lập của Việt Nam sau khi Nhật đầu hàng, được công bố vào tháng 3 và đồng thời gửi một thông điệp đến De Gaulle yêu cầu công nhận nền độc lập của Việt Nam. Thông điệp này cho rằng sự độc lập của Việt Nam "chỉ có nghĩa là bảo vệ lợi ích của Pháp và ảnh hưởng tinh thần Pháp ở Đông Dương".[cần dẫn nguồn] Tuy nhiên De Gaulle dự kiến sẽ hậu thuẫn cho một chế độ quân chủ mà người đứng đầu không phải là Bảo Đại, người đã thỏa hiệp với Nhật Bản để được "độc lập", mà là Vĩnh San, được xem như là một người "Gaullist".[16]
Từ cuối tháng 9 năm 1945 quân đội Pháp núp dưới bóng quân Anh vào giải giáp vũ khí quân Nhật, đã quay trở lại miền Nam Việt Nam. Sự việc này nằm trong tính toán của chính quyền Charles de Gaulle khi Đại chiến thế giới II chưa kết thúc.
Trong thời gian đầu, Chính phủ Việt Nam Dân chủ Cộng hòa kiên quyết chống lại việc Pháp tái lập chủ quyền ở Đông Dương. Sau đó, theo quan điểm của Ban Thường vụ TW 3 Đảng cộng sản Đông Dương (đã lui vào hoạt động bí mật), tháng 3 năm 1946, nếu Pháp cho Đông Dương tự trị theo tuyên bố ngày 24 tháng 3 năm 1945 thì kiên quyết đánh, nhưng nếu cho Đông Dương tự chủ thì hòa để phá tan âm mưu của "bọn Tàu trắng, bọn phản động Việt Nam và bọn phát xít Nhật còn lại". Đến ngày 6 tháng 3, 1946, Chính phủ ký với Pháp Hiệp định sơ bộ Pháp-Việt 1946, cho phép quân đội Pháp ra Bắc thay thế quân Trung Hoa giải giáp quân đội Đế quốc Nhật Bản. Pháp hứa sẽ rút hết quân trong thời hạn 5 năm, mỗi năm rút 3.000 quân. Ngược lại, Chính phủ Pháp công nhận nước Việt Nam Dân chủ Cộng hòa là một quốc gia tự do trong Liên bang Đông Dương và trong khối Liên hiệp Pháp, có chính phủ, nghị viện, quân đội và tài chính riêng. Trước đó Pháp và Trung Hoa đã ra thỏa thuận tại Trùng Khánh (Hiệp ước Hoa -Pháp), đồng ý cho quân Pháp ra miền Bắc Việt Nam (28 tháng 2) nhưng khi quân Pháp đổ bộ vào Hải Phòng đã xung đột với quân Trung Hoa dân quốc và lực lượng quân sự địa phương của Việt Nam Dân chủ Cộng hòa.
Một số thành viên trong Chính phủ Liên hiệp thuộc Việt Quốc, Việt Cách... không tán thành việc này, đã lên tiếng phản đối, dân chúng cũng có người băn khoăn, nhưng Chủ tịch Hồ Chí Minh đã bình tĩnh giải thích và động viên đồng bào để đồng bào hiểu rõ "cần phải biết chịu đựng hy sinh để mưu sự nghiệp lớn"[17]. Mặc dù Hiệp định có chữ ký của Vũ Hồng Khanh nhưng đa số lãnh đạo Việt Quốc rút sự ủng hộ của họ cho chính phủ Hồ Chí Minh để phản đối, chống lại những gì họ gọi là "thân Pháp" trong chính sách của Việt Minh. Bảo Đại rời khỏi đất nước vào ngày 18 tháng 3, ngày quân Pháp vào Hà Nội. Một hội nghị liên tịch được tổ chức để khai thông các bất đồng dẫn đến việc thành lập Hội Liên hiệp Quốc dân Việt Nam[18].
Hiệp định Sơ bộ ấn định lực lượng Pháp sau khi trở ra Bắc, phải rút hết sau một thời gian hai bên quy định không quá 5 năm. Trong khi đó hai bên đình chiến. Nước Pháp cũng công nhận Việt Nam Dân chủ Cộng hòa là một nước tự do, có chính phủ, nghị viện, quân đội, tài chính riêng và là một thành viên trong Liên bang Đông Dương thuộc khối Liên hiệp Pháp. Vấn đề độc lập của Việt Nam bị gác sang một bên vì Pháp không muốn bàn tới.
Việt Nam nhượng bộ về mọi mặt: kinh tế, tài chính và quân sự nhưng phái đoàn Việt Nam đòi Pháp ấn định thời hạn để thực hiện cuộc trưng cầu dân ý ở Nam Kỳ. Thấy Pháp chần chừ không trả lời dứt khoát, phái đoàn Việt Nam bỏ bàn hội nghị ra về ngày 13 tháng 9. Hội nghị Fontainebleau vì vậy tan vỡ.
Tuy nhiên Hồ Chí Minh và Bộ trưởng Bộ Thuộc địa Pháp Marius Moutet không chấp nhận thất bại. Trong khi Phạm Văn Đồng bỏ về nước, Hồ Chí Minh, Hoàng Minh Giám và Dương Bạch Mai nán lại Paris. Nhằm cứu vớt hòa bình lần cuối Hồ Chí Minh thảo một bản nghị ước vào chiều ngày 11 và trao cho Marius Moutet.[23] Ba ngày sau, 14 tháng 9 năm 1946, Marius Moutet hồi đáp với một bản nghị ước khác. Đạt được đồng thuận, Hồ Chí Minh đã đến tư dinh của Marius Moutet lúc nửa đêm ngày 14 tháng 9 năm 1946 để ký văn bản này, tức Tạm ước Việt - Pháp (Modus vivendi).[20]
Ngày 14 tháng 9 năm 1946, Pháp và Chính phủ Việt Nam Dân chủ Cộng hòa ký Tạm ước Việt - Pháp (Modus vivendi). Trong bản Tạm ước này, hai bên Việt Nam Dân chủ Cộng hòa và Pháp cùng bảo đảm với nhau về quyền tự do của kiều dân, chế độ tài sản của hai bên; thống nhất về các vấn đề như: hoạt động của các trường học Pháp, sử dụng đồng bạc Đông Dương làm tiền tệ, thống nhất thuế quan và tái lập cải thiện giao thông liên lạc của Liên bang Đông Dương, cũng như việc thành lập ủy ban tạm thời giải quyết vấn đề ngoại giao của Việt Nam. Chính phủ Việt Nam cam kết ưu tiên dùng người Pháp làm cố vấn hoặc chuyên môn, và hai bên đã đồng ý chấm dứt mọi hành động xung đột, vũ lực cũng như tuyên truyền chống đối nhau, phóng thích tù nhân chính trị, bảo đảm không truy bức người của bên kia, và hợp tác để những kiều dân hai bên không làm hại nhau. Tạm ước cam kết sẽ có một nhân vật do Việt Nam chỉ định và Chính phủ Pháp công nhận được uỷ nhiệm cạnh thượng sứ để xếp đặt cộng tác thi hành những điều thoả thuận này. Cuối cùng, Chính phủ hai bên sẽ sớm tiếp tục đàm phán (chậm nhất là vào tháng 1 năm 1947) để tìm cách ký kết những bản thoả thuận riêng nhằm dọn đường cho một hiệp ước chung dứt khoát.[24][25]
Sau sự kiện Hải Phòng, kế hoạch phòng thủ Hà Nội bắt đầu được chuẩn bị để chính phủ Việt Nam có thời gian sơ tán về các vùng núi lân cận. Một số ít lực lượng chính phủ đóng tại Bắc Bộ phủ và một doanh trại gần đó. Còn phần lớn lực lượng quân sự của Việt Nam trong vùng đóng tại ngoại ô của thủ đô. Bù lại, trong nội thành có gần 10.000 du kích và tự vệ. Đối địch với họ là vài nghìn lính Lê dương Pháp.
Các cơ quan của chính phủ Việt Nam bí mật chuyển dần ra các địa điểm đã được chuẩn bị trước ở bên ngoài thành phố. Trong thành phố, quân dân Hà Nội bắt đầu xây dựng các chiến lũy phòng thủ trên đường phố, quân Pháp cũng củng cố các vị trí phòng thủ của mình. Ngày 6 tháng 12, Hồ Chí Minh kêu gọi Pháp rút về các vị trí họ đã giữ từ trước ngày 20 tháng 11, nhưng ông không nhận được phản hồi. Trả lời phỏng vấn của nhà báo Pháp vào hôm sau, Hồ Chủ tịch khẳng định rằng Chính phủ Việt Nam hy vọng tránh được chiến tranh - cái sẽ gây đau khổ lớn cho cả hai nước. "Nhưng nếu chúng tôi phải đối mặt với chiến tranh", ông nói, "chúng tôi sẽ chiến đấu chứ không từ bỏ quyền tự do của mình".
Ngày 12 tháng 12, Léon Brum, thủ tướng mới của Pháp tuyên bố ý định giải quyết xung đột ở Đông Dương theo cách sẽ trao lại độc lập cho Việt Nam. Ba ngày sau, Hồ Chí Minh đưa Sainteny một bức thông điệp gửi Brum với các gợi ý cụ thể về cách giải quyết xung đột. Sainteny đánh điện bức thông điệp vào Sài Gòn, yêu cầu chuyển tiếp tới Paris.
Trong khi chính phủ Pháp đang do dự về yêu cầu của Cao ủy Đông Dương Georges D'Argenlieu về việc tăng quân và lập tức hành động quân sự chống lại người Việt, Valluy, người có chung quyết tâm với d'Argenlieu về việc giữ sự hiện diện của Pháp tại Đông Dương, đã quyết định rằng cần phải khiêu khích Hà Nội nhằm tạo xung đột và đưa Paris vào sự đã rồi. Ngày 16 tháng 12, ông lệnh cho tướng Morlière phá các chướng ngại vật mà Việt Minh dựng trong thành phố. Khi bức điện của Hồ Chí Minh gửi Brum vào đến Sài Gòn, Vallue viết thêm bình luận của mình, cảnh báo rằng sẽ nguy hiểm nếu trì hoãn các hành động quân sự cho đến năm sau. Đến ngày 19, bức điện mới đến Paris, khi đó đã quá muộn.
Ngày 17 tháng 12, quân Pháp với xe tăng yểm trợ vào các đường phố Hà Nội để phá các công sự mà Việt Minh dựng trong những ngày trước đó, gây ra vụ thảm sát ở phố Hàng Bún (Hà Nội), rồi dàn quân ra chốt giữ từ cổng thành Hà Nội đến tận cầu Long Biên và bao vây gây sức ép đồn Công an quận 2 của Hà Nội. Người Việt không phản ứng. Hôm sau, Pháp ra một tối hậu thư đòi chấm dứt dựng chướng ngại vật trên phố. Chiều hôm đó, Pháp ra tối hậu thư thứ hai tuyên bố rằng từ ngày 20, quân Pháp sẽ tự mình đảm nhiệm việc trị an ở Hà Nội. Đáp lại, tối hôm đó, các lực lượng Việt Minh bắt đầu chặn mọi ngả đường từ ngoại ô vào thành phố. Sáng hôm sau (ngày 19 tháng 12), Pháp ra tối hậu thư thứ ba, đòi chính phủ Việt Nam đình chỉ mọi hoạt động chuẩn bị chiến tranh, tước vũ khí của Tự vệ tại Hà Nội, và trao cho quân đội Pháp việc duy trì an ninh trong thành phố.
Đối với người Việt, tình hình không khác với sự kiện Hải Phòng hồi tháng trước, khi Đại tá Dèbes cũng đã ra các lệnh tương tự trước khi bắn phá thành phố. Sáng ngày 18 tháng 12, Hồ Chủ tịch ra lệnh chuẩn bị cho các cuộc tấn công quân Pháp vào hôm sau. Đồng thời, sợ rằng bức điện gửi Thủ tướng Brum có thể chưa đến nơi, ông gửi một bức điện thẳng tới Paris. Sáng 19, để thể hiện thiện chí và cố gắng cứu vãn hòa bình, Hồ Chủ tịch viết một bức thư ngắn và cử cố vấn ngoại giao Hoàng Minh Giám tới gặp Sainteny để đàm phán "tìm giải pháp để cải thiện bầu không khí hiện tại". Sau khi được tin Sainteny từ chối gặp Hoàng Minh Giám, Hồ Chủ tịch triệu tập Hội nghị Thường vụ Trung ương Ðảng mở rộng tại làng Vạn Phúc, Hà Nội, và tuyên bố rằng trong tình hình hiện tại, không thể nhân nhượng thêm được nữa. Hội nghị duyệt lại Lời kêu gọi toàn quốc kháng chiến mà Hồ Chủ tịch đã viết, thông qua văn kiện "Toàn dân kháng chiến" do Tổng Bí thư Trường Chinh dự thảo. Thời điểm bắt đầu nổ súng được quyết định là 8 giờ tối cùng ngày. Chiến tranh Đông Dương bắt đầu.
Leclerc, người tham gia Hiệp định sơ bộ 6 tháng Ba, cũng đã điều tra sự cố dẫn đến xung đột tại miền Bắc Việt Nam và việc Việt Nam Dân chủ Cộng hòa tuyên bố kháng chiến khiến các giải pháp chính trị thất bại. Ngày 27 tháng Giêng năm 1947, tuyên bố của chính phủ Pháp về "Chi tiết các mục tiêu theo đuổi của Pháp ở Đông Dương" có nêu "để đạt được càng sớm càng tốt với các đại diện đủ điều kiện của người An Nam một thỏa thuận phù hợp với nguyện vọng chính đáng trong Liên hiệp Pháp (...) trên cơ sở độc lập của đất nước cùng với việc duy trì lợi ích của Pháp và sự hiện diện của (các) căn cứ chiến lược của lực lượng Pháp. Một hỗ trợ lớn và ngay lập tức phải nhằm củng cố chính quyền của Nam Kỳ, nhưng "phần nào đủ điều kiện" để không đóng cánh cửa đàm phán với Việt Minh." [29]
Lập trường của Việt Nam Dân chủ Cộng hòa tại bàn đàm phán là: Pháp phải thừa nhận chủ quyền và độc lập của Việt Nam, Campuchia và Lào và rút quân đội khỏi 3 nước này; tiến hành tổng tuyển cử ở ba nước để thành lập các chính phủ thống nhất. Những cuộc tuyển cử trên phải được tiến hành với điều kiện tất cả các đảng phái và tổ chức yêu nước được tự do hoạt động dưới sự giám sát của các ủy ban địa phương. Nếu các điều kiện trên được chấp nhận chính phủ các nước Đông Dương đồng ý xem xét vấn đề gia nhập khối Liên hiệp Pháp. Việt Nam Dân chủ Cộng hòa đề nghị tham gia đàm phán có đại diện Chính phủ kháng chiến Lào, Campuchia nhưng các nước phương Tây từ chối.
Theo Hiệp định đã ký kết tất cả ba nước Đông Dưong phải đình chỉ chiến sự và rút quân đội các bên đến khu vực quy định. Theo Hiệp định Genève về Việt Nam, nước Việt Nam tạm thời bị chia thành hai vùng có giới tuyến là vĩ tuyến 17 trong 2 năm:
Ngay sau thời khắc chia đất nước ra làm hai vùng, đã diễn ra cuộc di cư lớn của gần 900.000 người dân miền Bắc, mà đa số là người Công giáo, vào miền Nam, với niềm tin "theo Chúa vào Nam". Một số người tin theo lời người Pháp cho rằng họ sẽ bị những chính sách của chính quyền miền Bắc bức hại bản thân họ. Khoảng 140 ngàn người khác ở miền Nam, gồm phần lớn là lực lượng kháng chiến của Việt Nam Dân chủ Cộng hòa tại miền Nam hoặc những người đi theo chủ nghĩa cộng sản, tập kết ra miền Bắc theo Hiệp định Genève. Theo như Bản tuyên bố cuối cùng của Hội nghị Genève, sẽ có một cuộc tổng tuyển cử ở cả hai miền sau hai năm để thống nhất đất nước.
Với sự viện trợ của Liên Xô và Trung Quốc, Việt Nam Dân chủ Cộng hòa đã hỗ trợ người và của cho Mặt trận Dân tộc Giải phóng miền Nam Việt Nam để đối đầu với Hoa Kỳ và Việt Nam Cộng hòa suốt 16 năm (1959-1975), Việt Nam Dân chủ Cộng hòa luôn là hậu phương lớn của chiến trường miền Nam.
Trong thời Chiến tranh Việt Nam, lãnh thổ của Việt Nam Dân chủ Cộng hòa chịu nhiều tác hại của cuộc chiến vì các chiến dịch ném bom của quân đội Mỹ với mục đích ngăn chặn sự chi viện của hậu phương miền Bắc cho chiến trường miền Nam Việt Nam. Theo ước tính, không quân Hoa Kỳ đã ném xuống Việt Nam Dân chủ Cộng hòa khoảng 3 triệu tấn bom các loại.
Tổ chức chính quyền đầu tiên là Chính phủ Cách mạng Lâm thời, thành lập ngày 27 tháng 8, 1945 trên cơ sở Ủy ban Dân tộc Giải phóng Việt Nam do Việt Minh thành lập trong Cách mạng tháng Tám. Chính phủ Cách mạng Lâm thời tuyên bố "Chính phủ lâm thời không phải là Chính phủ riêng của Mặt trận Việt Nam độc lập đồng minh (Việt Minh) như có người đã lầm tưởng. Cũng không phải là một Chính phủ chỉ bao gồm đại biểu của các chính đảng. Thật là một Chính phủ quốc gia thống nhất, giữ trọng trách là chỉ đạo cho toàn quốc, đợi ngày triệu tập được Quốc hội để cử ra một Chính phủ Dân chủ Cộng hoà chính thức." đồng thời kêu gọi "Vận mệnh ngàn năm của dân tộc đang quyết định trong lúc này. Toàn thể quốc dân hãy khép chặt hàng ngũ, đứng dưới lá quốc kỳ, làm hậu thuẫn cho Chính phủ lâm thời, đặng nắm chắc tự do độc lập, cải tạo tổ quốc bấy nhiêu lâu đã bị bọn giặc nước tàn phá. Cuộc đấu tranh cho độc lập, tự do, hạnh phúc của dân tộc đang tiếp tục. Bước đường giải phóng dân tộc còn nhiều chông gai hiểm trở. Quốc dân hãy sẵn sàng nghe hiệu lệnh của Chính phủ, hy sinh phấn đấu bảo vệ quyền độc lập hoàn toàn.".[32] Cựu hoàng Bảo Đại và Giám mục Lê Hữu Từ được mời làm Cố vấn Tối cao Chính phủ Việt Nam Dân chủ Cộng hòa.
Trong cuộc họp đầu tiên của Chính phủ Cách mạng Lâm thời (3/9/1945), toàn bộ các thành viên trong chính phủ đã thống nhất các phương pháp Chủ tịch chính phủ Hồ Chí Minh để giải quyết các vấn đề cấp bách của nước mới, bao gồm[38]:
Để giải quyết tận gốc nạn đói, Chính phủ Cách mạng lâm thời Việt Nam Dân chủ Cộng hòa kêu gọi nhân dân tăng gia sản xuất. Chính phủ còn vận động tư nhân cho mượn các vườn trống quanh nhà để tăng gia sản xuất. Mỗi địa phương lập ra một tiểu ban để huy động nhân lực và tổ chức sản xuất, lương thực làm ra được dùng để cứu tế. Cuối năm 1945 đầu 1946 không còn kịp thời vụ để trồng lúa nữa, nên chính phủ phát động dành phần lớn đất đai để tranh thủ trồng liên tiếp hai vụ màu (khoai lang, đậu, bắp ...) bù cho phần lúa thiếu hụt. Kết quả sản lượng màu đã tăng gấp 4 lần so với thời kỳ trước năm 1945. Chỉ trong 5 tháng từ tháng 11/1945 đến tháng 5/1946 đã đạt 614.000 tấn, tương đương 506.000 tấn lúa, đủ đắp được số thiếu hụt của vụ mùa năm 1945.[39]
Trong năm 1946, nạn đói cơ bản đã được giải quyết. Ngày 2/9/1946, Bộ trưởng Bộ Nội vụ Võ Nguyên Giáp tuyên bố: “Cuộc cách mạng đã chiến thắng được nạn đói, thật là một kỳ công của chế độ dân chủ”. Giáo sư kinh tế Đặng Phong đánh giá việc giải quyết được nạn đói là lý do giải thích tại sao tuyệt đại đa số dân chúng đã tin và đi theo Việt Minh.[39]
Một thành tựu khác của chính quyền Việt Nam Dân chủ Cộng hòa non trẻ là xóa mù chữ. Năm 1945, có 95% dân số Việt Nam mù chữ. Trước thực trạng đó, để xóa mù chữ, từ ngày 8 tháng 9 năm 1945 Chủ tịch Hồ Chí Minh ra các sắc lệnh: Sắc lệnh số 17 đặt ra một bình dân học vụ trong toàn cõi Việt nam, Sắc lệnh số 19 lập cho nông dân và thợ thuyền những lớp học bình dân buổi tối, Sắc lệnh số 20 định rằng việc học chữ quốc ngữ từ nay bắt buộc và không mất tiền. Để phục vụ chiến dịch xoá mù chữ, Nha Bình dân học vụ được thành lập ngày 18 tháng 9 năm 1945. Ngày 4 tháng 10 năm 1945, Chủ tịch Hồ Chí Minh ra lời kêu gọi Chống nạn thất học gửi tới toàn dân: "...Muốn giữ vững nền độc lập, muốn làm cho dân mạnh nước giàu, mọi người Việt nam phải hiểu biết quyền lợi của mình, bổn phận của mình, phải có kiến thức, mới có thể tham gia vào công cuộc xây dựng nước nhà và trước hết phải biết đọc, biết viết chữ quốc ngữ. Những người đã biết chữ hãy dạy cho những người chưa biết chữ, hãy góp sức vào bình dân học vụ…Những người chưa biết chữ hãy gắng sức mà học cho biết đi." Các lớp học Bình dân học vụ được mở khắp nơi ở cả ba miền thu hút sự tham gia của mọi lứa tuổi, mọi tầng lớp nhân dân. Người biết chữ dạy cho người không biết chữ. Đến tháng 9 năm 1946, phong trào Bình dân học vụ đã tổ chức được 75.000 lớp học với trên 95.000 giáo viên, trên 2.500.000 người được phong trào dạy biết đọc, biết viết.[40]
Theo Quyết nghị của Chính phủ, ngày 4/9/1945, Bộ trưởng Bộ Nội vụ Võ Nguyên Giáp thay mặt Chủ tịch Chính phủ lâm thời nước Việt Nam Dân chủ Cộng hoà, ký ban hành Sắc lệnh số 4 lập "Quỹ độc lập" với mục đích "để thu nhận các món tiền và đồ vật của nhân dân sẵn lòng quyên giúp Chính phủ để ủng hộ nền độc lập của Quốc gia". Tiếp sau đó, cũng trong khuôn khổ Quỹ độc lập, Chính phủ đã đề ra biện pháp tổ chức "Tuần lễ Vàng” từ ngày 17 đến ngày 24/9/1945.[41] Chủ tịch Hồ Chí Minh đã gửi thư cho đồng bào toàn quốc nhân dịp "Tuần lễ Vàng”, nêu rõ mục đích của việc lập quỹ là "thu góp số vàng trong nhân dân và nhất là của các nhà giàu có để dùng vào việc cần cấp và quan trọng nhất của chúng ta lúc này là việc quốc phòng”. Chính phủ đã huy động được tổng cộng 20 triệu đồng và 370kg vàng.[42] Ngân quỹ quốc gia đã có hàng trăm triệu đồng. Riêng tại Hà Nội, trong “Tuần lễ vàng" nhân dân đã góp được 2.201 lạng vàng, 920 tạ thóc cùng tiền bạc và các hiện vật khác, tổng trị giá lên 7 triệu đồng Đông Dương.[43] Số tiền này được dùng để mua vũ khí của quân đội Nhật bị quân đội Trung hoa Dân quốc tịch thu và để hối lộ cho các tướng lĩnh Trung Hoa đang đóng quân tại miền Bắc Việt Nam.[44]
Cùng các hình thức tổ chức "Quỹ độc lập", tuần lễ vàng chính quyền cách mạng còn tổ chức nhiều hình thức khuyến khích để nhân dân có điều kiện tham gia đóng góp cho tài chính đất nước với hình thức tự nguyện như lập "Quỹ kháng chiến", “Quỹ bình dân học vụ”, "Quỹ giải phóng quân", “Ngày Nam Bộ"... Sự đóng góp, ủng hộ nhiệt tình của nhân dân đã góp phần giải quyết khó khăn về tài chính của Việt Nam Dân chủ Cộng hòa.
Các tổ chức Việt Quốc (Vũ Hồng Khanh, Nguyễn Tường Tam đứng đầu), Việt Cách (đứng đầu là Nguyễn Hải Thần) cũng nhanh chóng từ Trung Quốc đi cùng quân Tưởng trở về Việt Nam. Thành phần các đảng phái này trong nước không mạnh như Việt Minh.[31][46]
Theo đại tướng Võ Nguyên Giáp, mục đích của Việt Quốc, Việt Cách để mở đường, tạo dựng cơ sở cho Quân đội Trung Hoa Dân quốc vào Việt Nam[38], gây xung đột vũ trang với Quân giải phóng và cướp chính quyền các địa phương[45][47] Dựa vào quân đội Tưởng, Việt Quốc và Việt Cách đã chiếm giữ một số nơi ở Yên Bái, Vĩnh Yên, Móng Cái, liên tục thực hiện các vụ quấy nhiễu, cướp phá, giết người, rải truyền đơn, ra báo Việt Nam, Thiết Thực, Đồng Tâm nhằm vu cáo nói xấu Việt Minh, chống chính quyền Việt Nam Dân chủ Cộng hòa và đòi gạt bỏ các bộ trưởng là đảng viên cộng sản ra khỏi chính phủ mới thành lập.[45] Cũng theo Đại tướng Võ Nguyên Giáp, do sống từ lâu ở nước ngoài, lại không có liên hệ gì với phong trào cách mạng trong nước, nên Việt Quốc, Việt Cách không nhận được sự ủng hộ của người dân. Tại nhiều nơi có quân Tưởng và Việt Quốc, Việt Cách đi qua; các cơ quan chính quyền, đoàn thể, lực lượng vũ trang đều dãn ra xung quanh tránh xô xát lớn. Nhân dân thực hiện "vườn không, nhà trống". Điều này đã khiến cho quân Tưởng gặp nhiều khó khăn trên đường đi, còn Việt Quốc, Việt Cách cũng thất bại trong việc khuếch trương thanh thế cũng như mục đích của mình.[48] Còn theo sử gia Trần Trọng Kim Việt Quốc, Việt Cách tuy có thế lực nhờ quân đội Trung Hoa Dân Quốc hỗ trợ, nhưng không thống nhất và không có kỷ luật chặt chẽ,[49] tuyên truyền nhiều mà không làm được việc gì đáng kể[50]. Thiếu tá Mỹ thuộc OSS, Al Patti nhận xét những người Quốc gia lưu vong chống cộng quyết liệt, có tham vọng nắm quyền lãnh đạo đất nước nhưng quá kém về tổ chức, thiếu sự liên kết chính trị, thiếu lãnh đạo và không có một chương trình hành động ra hồn mà chỉ hy vọng tạo ra một nước Việt Nam độc lập với sự giúp đỡ của Trung Quốc.[51] Sau khi thảo luận với các lãnh đạo Việt Cách và Việt Nam Quốc dân Đảng, ông nhận thấy những người này tuyệt nhiên không có ý tưởng nào về việc đáp ứng nhu cầu của nhân dân, không một ai có khái niệm về công việc sẽ làm mà chỉ chăm chăm mục tiêu "chia sẻ quyền lực với Việt Minh". Ông ta nhận xét: "Họ (Việt Cách, Việt Nam Quốc dân Đảng) là những kẻ lạc hướng về chính trị, có lẽ vì sống quá lâu ở Trung Quốc".[52]
Tưởng Giới Thạch không có ý định dính líu vào cuộc đấu tranh giành độc lập của Việt Nam. Ông không muốn làm mất lòng Pháp vì Pháp là một cường quốc trong khối Đồng Minh. Ông chủ trương rút hết quân về nước ngay sau khi giải giáp Nhật. Ngược lại tướng Lư Hán xem lập trường của Tưởng là thiển cận vì đi ngược lại các nguyên tắc của Hiến chương Đại Tây Dương đã được Trung Hoa Dân Quốc cam kết ủng hộ. Lư Hán chủ trương đóng quân tại miền Bắc Việt Nam lâu dài, đặt Việt Nam dưới sự bảo trợ của Trung Hoa Dân Quốc để Việt Nam có thể độc lập mà không cần đến sự ủng hộ của Pháp. Trong suốt thời gian đóng quân tại miền Bắc Việt Nam, Lư Hán dùng mọi khả năng của mình để làm thất bại mọi kế hoạch của Pháp giành lại quyền kiểm soát miền Bắc Việt Nam.[53] Người Pháp được đối xử như những người ngoại quốc khác, Pháp không được cử đại diện tham gia vào lễ đầu hàng của Nhật với tư cách một nước trong khối Đồng Minh, các chỉ huy Pháp tại Hà Nội cũng không được Lư Hán công nhận là đại diện của chính phủ De Gaulle. Bộ phận OSS của Mỹ tại miền Bắc Việt Nam cũng từ chối giúp các chỉ huy Pháp thiết lập một hành dinh tại Việt Nam.[54] Trước đó OSS đã được lệnh của Tổng thống Mỹ Franklin D. Roosevelt không để cho Pháp tái chiếm Đông Dương, không được cung cấp vũ khí hay tiếp tế cho Pháp ngoại trừ để thực hiện những mục tiêu chống Nhật đã được Đồng Minh tán thành.[55]
Việt Nam Quốc dân Đảng và Đại Việt Quốc dân Đảng ủng hộ quan điểm của Lư Hán về việc Trung Quốc đóng quân lâu dài tại Việt Nam để hỗ trợ cho nền độc lập của Việt Nam còn Việt Cách lại ủng hộ quan điểm của Tưởng Giới Thạch rút hết quân đội Trung Hoa Dân Quốc về nước sau khi giải giáp Nhật để Nguyễn Hải Thần lãnh đạo Việt Nam với sự hỗ trợ của Trung Hoa Dân Quốc.[56]
Trong hai ngày 18 và 19 tháng 9 năm 1945, Việt Minh họp bí mật với Việt Cách (ngày 18/9/1945) và Đại Việt (ngày 19/9/1945). Trong hai cuộc họp này, Nguyễn Hải Thần đại diện Việt Cách và Nguyễn Tường Tam đại diện Đại Việt Quốc dân Đảng đề nghị Hồ Chí Minh đồng ý hợp nhất Việt Minh với Việt Cách và Đại Việt Quốc dân Đảng. Đối với lời đề nghị này, trong nội bộ Việt Minh có nhiều ý kiến khác nhau. Võ Nguyên Giáp không đồng ý vì cho rằng những đề nghị đó không có giá trị và không thật thà, chẳng khác gì thay thế chủ nghĩa thực dân Pháp bằng ách thống trị của Trung Quốc nhưng Hoàng Minh Giám lại nghĩ rằng việc hợp nhất Việt Minh với các đảng phái Quốc gia sẽ làm giảm bớt sự đối lập và tăng cường thế lực cho Việt Minh, làm người Trung Quốc yên lòng còn Pháp phải lo ngại, quan trọng nhất là Chính phủ Việt Nam Dân chủ Cộng hòa trong con mắt của Đồng Minh, đặc biệt là Mỹ, là chính phủ thật sự dân chủ. Cuối cùng Việt Minh đã từ chối hợp nhất với Việt Cách và Đại Việt Quốc dân Đảng.[57]
Điều làm Hồ Chí Minh lo ngại là trong một số giới, đặc biệt là tầng lớp trung lưu Việt Nam, người ta vẫn xem ông và Việt Minh là cộng sản vì thế ông phải làm mọi cách để thay đổi điều này[58]. Tháng 11 năm 1945, ông quyết định cho Đảng Cộng sản Đông Dương tự giải tán. Về mặt công khai, đảng của ông không còn hiện diện mà chỉ có một bộ phận hoạt động dưới danh nghĩa Hội nghiên cứu chủ nghĩa Mác ở Đông Dương[59].
Ngày 19 tháng 11 năm 1945, tướng Tiêu Văn đứng ra tổ chức một cuộc hội nghị hòa giải có Việt Nam Quốc dân Đảng, Việt Nam Cách mạng Đồng minh hội và Việt Minh tham gia. Mặt trận Việt Minh đồng ý nhượng bộ với Việt Quốc, Việt Cách.[31][60] Lãnh đạo Việt Cách Nguyễn Hải Thần được bổ nhiệm vào ghế Phó Chủ tịch Chính phủ. Đồng thời hai ghế bộ trưởng Bộ Y tế và Bộ Vệ sinh, một ghế thứ trưởng Bộ Quốc dân Kinh tế được giao cho các thành viên của Việt Quốc, Việt Cách.[61][62] Tuy nhiên chức trách các Bộ cũng thay đổi. Bộ trưởng Quốc phòng trở thành người lo về tài chính mà không được xem xét danh sách nhân sự, quân số, súng đạn còn các Bộ trưởng khác của các đảng phái Quốc gia chẳng có chức trách cụ thể gì, không bao giờ được tham dự bất cứ buổi họp nào của nội các.[63]
Ngày 1 tháng 1 năm 1946 Chính phủ Liên hiệp Lâm thời được thành lập thay thế Chính phủ Cách mạng Lâm thời với sự tham gia của một số đảng phái đối lập (Việt Cách, Việt Quốc...) hoạt động ở Trung Quốc với sự bảo trợ của Trung Hoa Quốc Dân Đảng.[64]
Sau khi kết quả bầu cử được công bố, sự thật hoàn toàn không như các đảng phái tuyên truyền. Nhiều đại biểu có uy tín của các giai cấp, tầng lớp, tôn giáo, dân tộc đều trúng cử tại Quốc hội khóa I hầu hết chưa là đảng viên.[67]
Sau cuộc bầu cử, theo thỏa thuận với Việt Minh, phe đối lập bao gồm một số tổ chức như Việt Nam Cách mạng Đồng minh hội và Việt Nam Quốc dân Đảng được Trung Hoa Dân quốc ủng hộ, không tham gia Tổng tuyển cử nhưng vẫn được nắm 70 ghế Quốc hội cùng nhiều vị trí trong chính quyền trung ương do chính sách hòa hợp các đảng phái của Chính phủ. Trong hồi ký Những năm tháng không thể nào quên, đại tướng Võ Nguyên Giáp nhận định các đảng phái này lo sợ thất bại trước sức ủng hộ lớn của cử tri với mặt trận Việt Minh nên không tham gia bầu cử.[71]
Tại kỳ họp thứ nhất Quốc hội, theo đề nghị của đoàn chủ tịch (Ngô Tử Hạ điều khiển, với Nguyễn Đình Thi làm thư ký, các ghế Quốc hội phân chia tả hữu, theo đó Việt Quốc, Việt Cách (cánh hữu) ngồi bên tay phải, và các đại biểu Việt Minh, Marxist, Xã hội, Dân chủ ngồi bên tay trái, nhưng theo ý kiến của chủ tịch Hồ Chí Minh thì không nên phân chia như vậy, thể hiện một sự đoàn kết trong Quốc hội.
Về đối ngoại đã thực hiện đàm phán với Chính phủ Pháp, ký với đại diện chính phủ Cộng hòa Pháp J. Sainteny bản Hiệp định sơ bộ Pháp-Việt ngày 6 tháng 3 năm 1946 cho phép 15.000 quân Pháp ra Bắc thay thế cho 20 vạn quân Tưởng rút về nước. Sau khi bản Hiệp định sơ bộ Pháp-Việt được ký ngày 6 tháng 3 năm 1946, các đảng phái không cộng sản và thân nước ngoài như Việt Quốc và Việt Cách đã lên tiếng phản đối Chính phủ ký hiệp định này với Pháp.
Từ ngày 19 tháng 4 đến ngày 11 tháng 5 năm 1946 tại Đà Lạt, chính phủ tổ chức một hội nghị dự bị, gặp gỡ giữa 2 phái đoàn Việt và Pháp chuẩn bị cho Hội nghị Fontainebleau chính thức vào tháng 7 năm 1946.
Ngày 31 tháng 5 năm 1946, Chủ tịch Hồ Chí Minh lên đường sang Pháp theo lời mời của chính phủ nước này. Cùng ngày, phái đoàn chính phủ do Phạm Văn Đồng dẫn đầu cũng khởi hành. Trước khi đi, Hồ Chí Minh bàn giao quyền lãnh đạo đất nước cho quyền chủ tịch nước là cụ Huỳnh Thúc Kháng với lời dặn "Dĩ bất biến, ứng vạn biến". Trước khi lên đường sang Pháp, Hồ Chí Minh dự đoán thời gian ở Pháp "...có khi một tháng, có khi hơn"[74] nhưng cuối cùng Chủ tịch Hồ Chí Minh ở Pháp 4 tháng trong lúc phái đoàn do Phạm Văn Đồng dẫn đầu tham dự Hội nghị Fontainebleau (diễn ra từ 6 tháng 7 tới 10 tháng 9 năm 1946). Hội nghị Fontainebleau không đem lại kết quả cụ thể nào. Sau khi phái đoàn của Việt Nam về nước, tại Pháp, ngày 14 tháng 9 năm 1946, Chủ tịch Hồ Chí Minh ký với đại diện Pháp bản Tạm ước Việt - Pháp.
Ngày 15/6/1946, người lính cuối cùng của quân đội Trung Hoa Dân Quốc rời khỏi Việt Nam[75]. Các thành viên Việt Nam Quốc dân Đảng và Việt Nam Cách Mệnh Đồng minh hội mất chỗ dựa hậu thuẫn chính là quân đội Tưởng Giới Thạch và do bất đồng về việc ký Hiệp định sơ bộ Pháp-Việt mùng 6 tháng 3 đã lần lượt rút khỏi chính phủ Liên hiệp.[cần dẫn nguồn] Lãnh tụ đảng Việt Cách là Nguyễn Hải Thần và các thành viên Việt Quốc - Việt Cách khác trong chính phủ như Nguyễn Tường Tam, Vũ Hồng Khanh và cánh thân Tưởng do Vũ Hồng Khanh lãnh đạo lưu vong sang Trung Quốc. Các đảng viên Đại Việt phần lớn vẫn ở lại Việt Nam chờ thời cơ.[76]. Nguyễn Tường Tam với tư cách Bộ trưởng Bộ ngoại giao dẫn đầu phái đoàn Việt Nam Dân chủ Cộng hòa tham gia Hội nghị trù bị tại Đà Lạt, nhưng do bất đồng đã không tham gia hầu hết các phiên họp[77], sau đó cũng không tham gia Hội nghị Fontainebleau, cuối cùng rời bỏ chính phủ[78] (tài liệu nhà nước nêu Nguyễn Tường Tam thiếu bản lĩnh chính trị, lập trường bấp bênh, biển thủ công quỹ rồi đào nhiệm sang nước ngoài[79]). Việc các thành viên chủ chốt của Việt Quốc, Việt Cách như Nguyễn Hải Thần, Nguyễn Tường Tam, Vũ Hồng Khanh rời bỏ chính phủ, lưu vong sang Trung Quốc đã đánh dấu chấm hết cho thời kỳ hợp tác giữa Việt Minh và các đảng phái không cộng sản tại miền Bắc, trong công cuộc "kháng chiến kiến quốc" mà Chính phủ Liên hiệp Kháng chiến là biểu tượng.
Trong lúc đó, Võ Nguyên Giáp vội vã từng bước tìm cách loại bỏ dần các đảng phái đối lập như Việt Quốc, Việt Cách, Đại Việt, những người Trotskist, lực lượng chính trị Công giáo... Ngày 19/6/1946, Báo Cứu Quốc của Tổng bộ Việt Minh đăng xã luận kịch liệt chỉ trích "bọn phản động phá hoại Hiệp định sơ bộ Pháp Việt mùng 6 tháng 3". Ngay sau đó Võ Nguyên Giáp bắt đầu chiến dịch truy quét các đảng phái đối lập bằng lực lượng công an và quân đội do Việt Minh kiểm soát với sự giúp đỡ của nhà cầm quyền Pháp. Ông cũng sử dụng các sỹ quan Nhật Bản trốn tại Việt Nam và một số vũ khí do Pháp cung cấp cho chiến dịch này.[75]
Một trong những sự kiện nổi tiếng nhất trong chiến dịch tiêu diệt các đảng phái đối lập là vụ án phố Ôn Như Hầu. Sau khi từ Trung Quốc về Việt Nam, Việt Nam Quốc dân Đảng ngoài việc tìm cách lật đổ Việt Minh để cùng với các đảng phái Việt Cách, Đại Việt... chiếm chính quyền.[80] Việt Nam Quốc dân Đảng và Đại Việt Quốc dân đảng nhờ có vũ khí do Trung Hoa Dân Quốc chuyển giao còn tổ chức các đội vũ trang mang tên "Thần lôi đoàn", "Thiết huyết đoàn", "Hùm xám"... Các đội vũ trang này đã tổ chức nhiều vụ cướp có vũ trang, bắt cóc, tống tiền, tổ chức ám sát những người theo Việt Minh và cả những người trung lập như ông Ba Viên rồi tuyên truyền đổ lỗi cho Việt Minh đã không đảm bảo được an ninh trật tự ở Hà nội và một số đô thị ở Bắc Bộ.[81] Không những thế đầu tháng 6 năm 1946, Việt Nam Quốc dân Đảng tổ chức cho Nghiêm Xuân Chi (đảng viên Việt Quốc) ám sát một số lãnh đạo của Việt Minh như Võ Nguyên Giáp, Trường Chinh và ông Bồ Xuân Luật, một người cũ của Việt Cách nay đứng về phe Việt Minh.[82] Trước những hoạt động gây mất trật tự an ninh tại Hà Nội và một số thành phố ở Bắc Bộ, Sở Công an Bắc Bộ đã lập chuyên án mà sau này được lấy tên công khai là Chuyên án số 7 phố Ôn Như Hầu[81]
Ngày 12/7/1946, Việt Nam Công an vụ theo ý kiến chỉ đạo của Trường Chinh (Tổng Bí thư Đảng Cộng sản Đông Dương, khi đó rút vào hoạt động bí mật. Chức danh công khai là Hội trưởng Hội nghiên cứu Chủ nghĩa Mác ở Đông Dương)[83], đã thực hiện phá vụ án phố Ôn Như Hầu. Chỉ đạo trực tiếp lực lượng công an phá vụ án này là các ông Lê Giản (Giám đốc Nha Công an Bắc bộ), Nguyễn Tuấn Thức (Giám đốc Công an Hà Nội) và Nguyễn Tạo (Trưởng nha Điệp báo Công an Trung ương).[84] Lực lượng công an xung phong đã thực hiện khám xét các trụ sở Việt Nam Quốc dân Đảng tại Hà Nội, bắt tại chỗ nhiều thành viên của Việt Nam Quốc dân Đảng cùng nhiều tang vật như truyền đơn, vũ khí, dụng cụ tra tấn, đồng thời phát hiện nhiều xác chết tại đó... Trong số các thành viên của Quốc dân Đảng bị bắt có một đại biểu Quốc hội Việt Nam khóa I là Phan Kích Nam. Theo điều tra của Nha công an, Việt Nam Quốc dân Đảng đang chuẩn bị những hành động khiêu khích rất nghiêm trọng. Dự định các thành viên của Việt Nam Quốc dân Đảng sẽ phục sẵn dọc đường quân Pháp diễu qua nhân ngày quốc khánh Pháp, bắn súng, ném lựu đạn để tạo ra những chuyện rắc rối giữa Pháp và Chính phủ, gây sự phá hoại hòa bình rồi tung truyền đơn hô hào lật đổ chính quyền và sau đó đứng ra bắt tay với Pháp.[76]
Trong ngày 12/7/1946, một tiểu đội công an do Lê Hữu Qua chỉ huy[85] bao vây khám xét trụ sở của đảng Đại Việt tại số 132 Duvigneau, do nghi ngờ Đại Việt cấu kết với Pháp âm mưu tiến hành đảo chính chính quyền cách mạng đúng vào ngày quốc khánh Pháp 14/7/1946.[84] Khi thực hiện cuộc bao vây khám xét này, lực lượng công an chưa có chứng cứ cụ thể và chưa có lệnh của cấp trên. Nhưng vẫn thực hiện bao vây khám xét để các thành viên Đại Việt không có thời gian rút vào bí mật và tẩu tán truyền đơn, hiệu triệu lật đổ chính quyền. Lực lượng công an đột kích bất ngờ vào sáng sớm khiến cho lính canh và các đảng viên Đại Việt không kịp có hành động trở tay.[85] Tại trụ sở của Đại Việt, lực lượng công an đã tìm thấy nhiều truyền đơn, hiệu triệu chưa kịp tẩu tán cùng nhiều súng ống, lựu đạn.
Ngày 16 tháng 7, quyền chủ tịch nước Huỳnh Thúc Kháng đã có tuyên bố trấn an dư luận: "Những đảng viên Việt Nam Quốc dân Đảng chân chính, được bảo đảm sự tự do hoạt động trong vòng pháp luật...Những kẻ bắt cóc, tống tiền, ám sát thì phải đem ra pháp luật nghiêm trị. Đây không phải là vấn đề đảng phái. Việc khám xét vừa rồi là việc phải làm để bảo vệ trị an...".[86]
Theo quy định của luật pháp thì Phó Chủ tịch nước và bộ trưởng do Quốc hội bầu, và chỉ phế truất bởi Quốc hội theo thủ tục quy định của pháp luật.[87] Trong phiên điều trần trước Quốc hội kỳ họp thứ hai liên quan Tạm ước và một số thành viên rời Chính phủ, Hồ Chí Minh có nói:
Tạm ước này có ảnh hưởng tới các hiệp ước ký sau không? Trong xã hội loài người, có cái gì mà không ảnh hướng tới cái khác. Tuy vậy, những sự điều đình sau đây không thể vì bản tạm ước này mà bị ràng bó. Bản Tạm ước này tùy theo sự thi hành thế nào, sẽ tạo điều kiện đẩy cho những cuộc điều đình sau mau chóng đạt kết quả.Về ông Phó Chủ tịch Nguyễn Hải Thần, ông Bộ trưởng Ngoại giao Nguyễn Tường Tam, ông Phó Chủ tịch Quân ủy hội Vũ Hồng Khanh, các ông ấy không có mặt ở đây. Lúc Nhà nước đương gặp bước khó khăn, quốc dân tin ở người nào trao người ấy làm công việc lớn mà các ông ấy lại bỏ đi thì các ông ấy phải hỏi lương tâm thế nào? Những người đã bỏ việc đi kia, họ không muốn gánh vác việc nước nhà hoặc họ cũng không đủ năng lực gánh vác, nay chúng ta không có họ ở đây chúng ta cũng cứ gánh vác được như thường[88].
Dù vậy một số thành viên của Việt Quốc, Việt Cách như Chu Bá Phượng, Bồ Xuân Luật vẫn tiếp tục tham gia Chính phủ, kể cả khi lên Việt Bắc. Trương Đình Tri vẫn tiếp tục tham gia chính phủ sau vụ án Ôn Như Hầu[89]. Tại kỳ họp thứ hai Quốc hội, vẫn có 37 đại biểu Việt Quốc, Việt Cách tham gia.
Ngày 9 tháng 11 năm 1946, tại kỳ họp thứ hai Quốc hội khóa I đã thông qua Hiến pháp nước Việt Nam Dân chủ Cộng hòa. Dự kiến trưng cầu dân ý toàn quốc thông qua Hiến pháp, bầu cử Nghị viện nhân dân theo quy định của Hiến pháp mới thay cho Quốc hội lập hiến, nhưng chiến tranh nên không thực hiện được. Khi đó Quốc hội chia theo nhóm: Marxist, xã hội chủ nghĩa, dân chủ, Việt Minh, Đồng Minh hội và Việt Nam Quốc dân Đảng,[90], không kể các đại biểu trung lập.
Tiếp đó, Dự án luật Lao động được thông qua và ban hành ngày 8 tháng 11 năm 1946. Đây là dự luật đầu tiên được thông qua.
Ngày 31 tháng 9 năm 1959, trong kỳ họp tại Hà Nội, Quốc hội khóa I thông qua Hiến pháp mới. Do tình hình chiến tranh, Hiến pháp 1946 chưa được chính thức công bố và chưa từng có hiệu lực về phương diện pháp lý.[91]
Thẩm quyền Tòa án nhân dân đặc biệt huyện hoặc liên huyện đặt dưới sự lãnh đạo của Ủy ban kháng chiến hành chính tỉnh và đi xử lưu động ở các xã có phát động quần chúng. Việc thành lập Toà án nhân dân đặc biệt ở huyện hay liên huyện do Uỷ ban kháng chiến hành chính tỉnh quyết định và Uỷ ban kháng chiến hành chính liên khu duyệt y. Tòa án nhân dân đặc biệt có Chánh án, 6 đến 10 thẩm phán, đa số là trung nông và bần cố nông, bần cố nông nhiều hơn trung nông. Chánh án và một nửa số thẩm phán do Uỷ ban kháng chiến hành chính tỉnh chọn lựa và Uỷ ban kháng chiến hành chính liên khu duyệt y. Một nửa số thẩm phán do Nông hội hoặc Hội nghị đại biểu nông dân ở huyện hay liên huyện cử ra. Khi đến xã nào xử thì lấy thêm đại biểu nông dân ở xã đó, nhưng số đại biểu lấy vào không được quá 1/3 tổng số thẩm phán. Sắc lệnh số 233/SL ngày 14/6/1955 sửa lại quy định trong Sắc lệnh 150/SL: Khi phân toà đến xã nào xử thì lấy thêm 5 đại biểu nông dân của xã đó. Số đại biểu này do Hội nghị đại biểu nông dân xã bầu ra, và phải là bần cố trung nông; số bần cố nông phải nhiều hơn trung nông. Các đại biểu này có quyền hạn và nhiệm vụ của những thẩm phán.
Tòa án này có quyền tuyên: tha bổng, cảnh cáo, bồi thường, tịch thu tài sản, tước quyền công dân, quản chế địa phương, phạt tù có thời hạn, phạt tù chung thân, xử tử hình. Đối với việc duyệt án, án tù dưới 5 năm do Uỷ ban kháng chiến hành chính tỉnh duyệt và do Chủ tịch Uỷ ban kháng chiến hành chính tỉnh ký vào bản án. án từ 5 năm tù trở lên chung thân và án tử hình thì do Uỷ ban kháng chiến hành chính liên khu duyệt và do Chủ tịch Uỷ ban kháng chiến hành chính liên khu ký vào bản án. Trong 10 ngày sau khi tuyên án, người bị án có quyền chống án.
Ngày 14/12/1956, Chủ tịch nước Việt Nam Dân chủ Cộng hòa ra sắc lệnh số 282/SL quy định về chế độ báo chí. Sắc lệnh này quy định tất cả các báo chí đều được hưởng quyền tự do ngôn luận, không phải kiểm duyệt trước khi in (Điều 4). Muốn xuất bản một tờ báo phải xin phép trước, phải làm đầy đủ những thủ tục về khai báo. Sau khi được cơ quan phụ trách về báo chí của Chính phủ cấp giấy phép, tờ báo mới bắt đầu được hoạt động (điều 8).[97]
Ngày 20/5/1957, Chủ tịch nước Việt Nam Dân chủ Cộng hòa ra sắc lệnh số 102/SL-L004 ban hành Luật quy định quyền lập hội. Luật này quy định lập hội phải xin phép và thể lệ lập hội sẽ do Chính phủ quy định (điều 3). Đồng thời những hội đã thành lập trước ngày ban hành Luật quy định quyền lập hội và đã hoạt động trong vùng tạm bị chiếm trong thời kỳ kháng chiến, nay muốn tiếp tục hoạt động, đều phải xin phép lại (điều 4).[98]
Thời kỳ kháng chiến, tổ chức thêm các đơn vị hành chính cấp Khu và Liên khu. Thủ đô kháng chiến đặt ở Việt Bắc.
Theo Hiến pháp năm 1959, Việt Nam Dân chủ Cộng hòa phân cấp hành chính như sau:
Trong thành phố trực thuộc trung ương, thời kỳ 1954-1958 có các cấp
hành chính quận (ở cả nội thành và ngoại thành), dưới quận có khu phố (ở
nội thành) và xã (ở ngoại thành, ngoài ra có phố là cấp không thông
dụng, như phố Gia Lâm ở Hà Nội). Năm 1958, nội thành bỏ quận, thay bằng
khu phố (gọi tắt là khu), dưới khu phố là khối dân phố, ngoại thành có
quận (từ năm 1961 đổi là huyện) và xã. Năm 1974, đổi tên gọi khối dân
phố thành cấp tiểu khu.
Từ năm 1955, Việt Nam Dân chủ Cộng hòa đã thiết lập Khu tự trị Thái Mèo (sau đổi là Khu tự trị Tây Bắc), gồm ba tỉnh Lai Châu, Sơn La, Nghĩa Lộ, và năm 1956 thiết lập Khu tự trị Việt Bắc gồm 6 tỉnh Cao Bằng, Lạng Sơn, Thái Nguyên, Bắc Cạn, Hà Giang, Tuyên Quang. Khu tự trị là đơn vị hành chính đệm giữa Trung ương và cấp tỉnh. Năm 1975 cấp này bị bãi bỏ.
Trong 3.563 xã thuộc 22 tỉnh và những vùng ngoại thành ở miền Bắc đã thực hiện cải cách ruộng đất, các đội cải cách ruộng đất đã chỉ ra 47.890 địa chủ, chiếm 1,87% tổng số hộ và 2,25% tổng số nhân khẩu ở nông thôn. Trong số địa chủ đó, có 6.220 hộ là cường hào gian ác, chiếm 13% tổng số hộ địa chủ. Nghị quyết của Hội nghị Trung ương Đảng Lao động Việt Nam lần thứ 14 về tổng kết cải cách ruộng đất đã nêu rõ: "Những tên địa chủ có nhiều tội ác với nông dân và là phản động đầu sỏ cùng một số tổ chức của chúng đã bị quần chúng tố cáo và bị trừng trị theo pháp luật". Số địa chủ bị tuyên án tử hình trong chương trình Cải cách ruộng đất không được thống kê chính xác và gây tranh cãi. Các nhà nghiên cứu phương Tây đưa ra các số liệu rất khác nhau và không thống nhất, theo Gareth Porter: từ 800 đến 2.500 người bị tử hình;[101] theo Edwin E. Moise (sau một công cuộc nghiên cứu sâu rộng hơn): vào khoảng 5.000; theo giáo sư sử học James P. Harrison: vào khoảng 1.500 người bị tử hình cộng với 1.500 bị giam giữ.[102]. Do tiến hành vội vã, nhiều địa chủ bị kết án oan sai, nên từ năm 1956, các chiến dịch sửa sai được tiến hành, các địa chủ bị kết án oan được trả tự do, minh oan, trả lại danh dự và được tạo điều kiện sinh sống[103]. Qua cải cách ruộng đất ở miền Bắc, trên 810.000 hecta ruộng đất của đế quốc và địa chủ, ruộng đất tôn giáo, ruộng đất công và nửa công nửa tư đã bị tịch thu, trưng thu, trưng mua để chia cho 2.220.000 hộ nông dân lao động và dân nghèo ở nông thôn, bao gồm trên 9.000.000 nhân khẩu. Như vậy là 72,8% số hộ ở nông thôn miền Bắc đã được chia ruộng đất. Tính đến tháng 4 năm 1953, số ruộng đất trực tiếp tịch thu của địa chủ chia cho nông dân bằng 67,67% tổng số ruộng đất mà địa chủ chiếm hữu nǎm 1945.[104]
Các nước Tây phương thì mãi đến năm 1967, Pháp mới lập phòng liên lạc và đại diện bán chính thức rồi đến Thụy Sĩ năm 1968. Tuy nhiên đây là chỉ cấp bán chính thức, không có đại sứ. Năm 1969 Thụy Điển là quốc gia Tây Âu đầu tiên thiết lập ngoại giao toàn phần với Miền Bắc kể cả trao đổi đại sứ. Theo sau đó là Senegal (1969), Ceylon (1970), Thụy Sĩ (1971), Ấn Độ (1972), Chile, và Pakistan. Tính đến hết tháng 12 năm 1972, có 49 quốc gia bang giao với nước Việt Nam Dân chủ Cộng hòa.[110]
Năm 1975 Việt Nam Dân chủ Cộng hòa cùng Cộng hòa Miền Nam Việt Nam đứng hai đơn gia nhập Liên hiệp quốc nhưng bị Hoa Kỳ phủ quyết cả hai.[111] Tuy nhiên cũng năm này Việt Nam Dân chủ Cộng hòa được gia nhập hai cơ quan quốc tế là WMO (World Meteorological Organization, Tổ chứ Khí tượng Thế giới) ngày 7 tháng 8, 1975 và WHO (World Health Organization, Tổ chức Y tế Thế giới) ngày 22 tháng 10, 1975. Đây là hai tổ chức quốc tế đầu tiên (không kể những tổ chức riêng của khối xã hội chủ nghĩa) quốc gia này tham gia.[110]
Ở miền Nam, Vệ quốc đoàn có nhiều đơn vị của các giáo phái Cao Đài, Hòa Hảo, Bình Xuyên tuy chấp hành những chỉ thị quân sự của cấp trên nhưng lại từ chối tiếp nhận các chính ủy do cấp trên cử xuống. Sau những xung đột quân sự giữa các đơn vị do giáo phái chỉ huy với những đơn vị do Việt Minh chỉ huy, và nhất là sau khi giáo chủ Huỳnh Phú Sổ của Hòa Hảo mất tích (Hòa Hảo cho là do Việt Minh thủ tiêu), lực lượng quân sự của các giáo phái Cao Đài, Hòa Hảo, Bình Xuyên ly khai khỏi Vệ quốc đoàn hợp tác với chính phủ Cộng hòa tự trị Nam Kỳ và sau này với Quốc gia Việt Nam.[cần dẫn nguồn]
Năm 1950, Quân đội Quốc gia Việt Nam đổi tên thành Quân đội Nhân dân Việt Nam. Sau 1954, quân đội Việt Nam Dân chủ Cộng hòa vẫn giữ tên gọi Quân đội Nhân dân Việt Nam.
- Hiệp ước liên quan tới Việt Nam
- Sự kiện lịch sử Việt Nam
- Quan hệ Việt Nam - Pháp
- Ngoại giao Pháp
- 1946
- Văn kiện trong Chiến tranh Đông Dương
- Ngoại giao trong Chiến tranh Đông Dương
Việt Nam Dân chủ Cộng hòa
Bách khoa toàn thư mở Wikipedia
|
||||||||||||||||||||||||||||||||||||||||||||||||
Trong Chiến tranh Thế giới II, Việt Nam là một thuộc địa của Pháp, nhưng lại nằm dưới sự chiếm đóng của Nhật Bản. Ngay sau khi Nhật Bản đầu hàng quân Đồng Minh và cuộc Cách mạng tháng 8 năm 1945 thành công, nước Việt Nam Dân chủ Cộng hòa được tuyên bố thành lập tại Hà Nội, chính quyền mới được thiết lập trên toàn bộ đất nước. Hồ Chí Minh người lãnh đạo Việt Minh, trở thành người đứng đầu chính phủ mới. Ngay sau khi Pháp quay trở lại Việt Nam năm 1945, thì cuộc Chiến tranh Đông Dương lần thứ nhất đã nổ ra vào năm 1946. Sau 9 năm chiến tranh, năm 1954 Hiệp định Geneva được ký kết giữa các bên tham chiến, Việt Nam bị chia làm 2 miền lấy vĩ tuyến 17 làm ranh giới. Việt Nam Dân chủ Cộng hòa là chính phủ ở miền Bắc Việt Nam, trong khi đó Quốc gia Việt Nam kiểm soát ở miền Nam Việt Nam.
Hiệp Định Geneva xác định cuộc tổng tuyển cử thống nhất 2 miền sẽ diễn ra vào năm 1956. Người Pháp chấp nhận đề nghị của thủ tướng Phạm Văn Đồng, trưởng phái đoàn đàm phán Việt Nam Dân chủ Cộng hòa[3], là cuộc tổng tuyển cử thống nhất sẽ được đặt dưới sự giám sát của các ủy ban tại chỗ.[4] Hoa Kỳ không công nhận Hiệp định Genève đồng thời thực hiện "Kế hoạch Hoa Kỳ" với sự ủng hộ từ phía Quốc gia Việt Nam và Vương quốc Anh, nhằm trợ giúp cho Quốc gia Việt Nam.[5]
Trong Chiến tranh Việt Nam (1955–1975), Việt Nam Dân Chủ Cộng hòa cùng các đồng minh ở phe Xã hội chủ nghĩa gồm cả Liên Xô và Trung Quốc đã chiến đấu chống lại quân đội của chính phủ Việt Nam Cộng hòa, Hoa Kỳ và các đồng minh gồm Australia, Hàn Quốc, Philippines, Thái Lan và các quốc gia khác. Ở thời điểm cao trào của cuộc chiến, Hoa Kỳ có tới 600.000 quân ở miền Nam Việt Nam. Đây là cuộc chiến tranh khốc liệt nhất trong thời kỳ Chiến tranh Lạnh, kéo dài 21 năm. Chiến tranh kết thúc với thắng lợi hoàn toàn của các lực lượng Cộng hòa Miền Nam Việt Nam dưới sự lãnh đạo của Đảng Lao động Việt Nam được Việt Nam Dân chủ cộng hòa hỗ trợ vào năm 1975. Hai nửa của Việt Nam (miền Bắc và miền Nam) đã thống nhất thành nước Cộng hoà xã hội chủ nghĩa Việt Nam vào năm 1976.
Mục lục
- 1 Lịch sử
- 2 Hành pháp
- 3 Lập pháp
- 4 Tư pháp
- 5 Phân cấp hành chính
- 6 Chính quyền địa phương
- 7 Các tổ chức chính trị
- 8 Kinh tế
- 9 Ngoại giao
- 10 Quân đội
- 11 Văn hóa, xã hội
- 12 Giáo dục
- 13 Lãnh đạo qua các thời kỳ
- 14 Nguồn tham khảo
- 15 Xem thêm
- 16 Liên kết ngoài
Lịch sử
Thành lập
Ngày 16/8/1945, Việt Minh tổ chức Đại hội Quốc dân ở Tân Trào. Đại hội này thông qua 10 chính sách lớn của Việt Minh, thông qua Lệnh tổng khởi nghĩa, quyết định Quốc kỳ nền đỏ, ở giữa có sao vàng năm cánh, chọn bài Tiến quân ca làm Quốc ca và bầu ra Ủy ban Dân tộc Giải phóng Việt Nam, sau này trở thành Chính phủ Cách mạng Lâm thời, do Hồ Chí Minh làm Chủ tịch.[7]
Từ ngày 14/8/1946 một số cán bộ Đảng Cộng sản Đông Dương và Việt Minh dù chưa nhận được lệnh khởi nghĩa nhưng căn cứ vào tình hình hiện tại và chỉ thị "Nhật - Pháp bắn nhau và hành động của chúng ta" đã quyết định phát động nhân dân khởi nghĩa tại các tỉnh miền Bắc, miền Trung như Thanh Hóa, Thái Bình, Khánh Hòa ... buộc Đế quốc Việt Nam giao chính quyền cho nhân dân. Cuộc khởi nghĩa lan rộng ra khắp cả nước.[8][9][10]
Ngày 19/8/1945, Việt Minh tổ chức một cuộc mít tinh tại Quảng trường Nhà hát lớn Hà Nội. Đại diện Việt Minh tuyên bố: Tổng khởi nghĩa! Sau đó một cánh tiến thẳng tới Phủ Khâm Sai, cơ quan đầu não của chính phủ Đế quốc Việt Nam tại miền Bắc, và nhanh chóng làm chủ toàn bộ khu vực này. Lính bảo vệ Phủ đã hạ vũ khí mà không có bất kỳ hành động kháng cự nào. Khâm sai Bắc kỳ Nguyễn Xuân Chữ (người mới đứng ra thay thế ông Phan Kế Toại) bị bắt giữ và đưa về An toàn khu tại Hà Đông.[11]
Trong Cách mạng Tháng Tám, Đảng Cộng sản Đông Dương (tổ chức nòng cốt của Việt Minh) đóng vai trò chỉ đạo chung thống nhất, đưa ra các quyết sách tổ chức tổng khởi nghĩa giành chính quyền từ tay chính quyền Đế quốc Việt Nam thân Nhật và lực lượng quân đội đế quốc Nhật Bản, dù trên thực tế ở một số tỉnh thành chưa có hay khôi phục lại tổ chức đảng. Tại miền Bắc, một số tỉnh chưa có tổ chức đảng nhưng mặt trận Việt Minh hoạt động rất mạnh hầu khắp các tỉnh thành. Tại miền Trung, hoạt động của mặt trận Việt Minh và Đảng Cộng sản khá mạnh. Trong khi đó ở Nam Bộ, hoạt động của Việt Minh có phần yếu hơn, Đảng Cộng sản chưa khôi phục đầy đủ sau Nam Kỳ Khởi Nghĩa. Trong Cách mạng Tháng Tám, tổ chức Việt Minh đã thu hút được cả lực lượng Thanh niên tiền tuyến do Chính phủ Đế quốc Việt Nam thành lập gia nhập Mặt trận Việt Minh. Tại một số tỉnh Nam Bộ, Thanh niên tiền phong đóng vai trò quan trọng giành chính quyền.[12]
Ngày 25 tháng 8, 1945, Bảo Đại đọc Tuyên ngôn Thoái vị trước hàng ngàn người tụ họp trước cửa Ngọ Môn và sau đó trao ấn tín, quốc bảo của hoàng triều cho ông Trần Huy Liệu. Bảo Đại trở thành "công dân Vĩnh Thụy". Bản Tuyên ngôn Thoái vị có câu nói nổi tiếng "Trẫm muốn được làm Dân một nước tự do, hơn làm Vua một nước bị trị".[13]
Ngày 27 tháng 8, 1945, theo đề nghị của Hồ Chí Minh, Ủy ban Dân tộc Giải phóng Việt Nam được cải tổ thành Chính phủ Cách mạng Lâm thời nước Việt Nam Dân chủ Cộng hoà. Nhiều Ủy viên Việt Minh trong Ủy ban Dân tộc Giải phóng Việt Nam đã tự nguyện rút ra khỏi Chính phủ để mời thêm nhiều nhân sĩ ngoài Việt Minh tham gia.[7]
Việt Nam Dân chủ Cộng hòa được thành lập vào ngày 2 tháng 9 năm 1945 (đây cũng là ngày quốc khánh của nước Cộng hòa Xã hội Chủ nghĩa Việt Nam hiện nay), sau Cách mạng Tháng Tám dưới sự lãnh đạo của mặt trận Việt Minh.
Việt Nam Dân chủ Cộng hòa tiến hành bầu cử Quốc hội đầu tiên vào ngày 6 tháng Giêng năm 1946. Hiến pháp thông qua ngày 9 tháng 11. Trong giai đoạn đầu khi thành lập chính quyền toàn quốc, Việt Minh mà Đảng Cộng sản làm nòng cốt giữ vai trò lãnh đạo. Trong một thời gian ngắn chính quyền bao gồm nhiều tổ chức, đảng phái chính trị tham gia ở cấp trung ương và địa phương (Việt Quốc, Việt Cách, Đại Việt, Trốtxkit, Cao Đài, Hòa Hảo,...). Sau một thời gian vài năm hoạt động bí mật, Đảng Cộng sản ra hoạt động bán công khai trong tổ chức Việt Minh và Liên Việt, và từ năm 1951 hoạt động công khai chính thức giữ vai trò lãnh đạo Nhà nước. Tham gia chính quyền sau năm 1954 còn có Đảng Dân chủ và Đảng Xã hội trong Mặt trận Tổ quốc Việt Nam, do Đảng Lao động lãnh đạo.
Giai đoạn 1945-1946
Pháp quay trở lại Việt Nam
Ngày 28/11/1943 trước hội nghị Teheran tổng thống Mỹ đã có ý kiến đặt Đông Dương dưới sự quản lý quốc tế. Liên Xô đã chấp thuận đề xuất này. Nhưng sau đó Mỹ ủng hộ Pháp để lôi kéo Pháp vào mặt trận chống Liên Xô. Mỹ cũng nhường chính quyền Tưởng Giới Thạch vào miền Bắc giải giáp quân đội Nhật.Sau khi Nhật đảo chính Pháp và tuyên bố trao trả độc lập cho Việt Nam. Ngày 11 tháng 3 năm 1945, Bảo Đại ra đạo dụ "Tuyên cáo Việt Nam độc lập", tuyên bố hủy bỏ Hòa ước Patenôtre ký với Pháp năm 1884, khôi phục chủ quyền Việt Nam, thống nhất Bắc Kỳ, Trung Kỳ và Nam Kỳ.[14] Trong tuyên bố của Bảo Đại, bãi bỏ các hiệp ước bảo hộ và mất độc lập với Pháp trước đây, độc lập theo tuyên ngôn Đại đông Á, và "ông cũng như Chính phủ Việt Nam tin tưởng lòng trung thực của Nhật Bản và nó được xác định làm việc với các nước để đạt được mục đích".[cần dẫn nguồn]
Ngày 24 tháng 3, 1945, sau khi Nhật đảo chính Pháp tại Đông Dương, de Gaulle đã tuyên bố khẳng định chủ quyền Pháp tại Đông Dương, nhưng sẽ cho Đông Dương tự trị và thực thi tự do dân chủ với Hội đồng liên bang được thành lập với không quá 50% là người bản xứ.
Ngày 7 tháng 4 năm 1945, Bảo Đại đã ký đạo dụ số 5 chuẩn y thành phần nội các Trần Trọng Kim và ngày 12 tháng 5 giải thể Viện Dân biểu Trung Kỳ.[cần dẫn nguồn] Tháng 6 năm 1945, chính phủ Trần Trọng Kim đặt quốc hiệu là Đế quốc Việt Nam.
Ngày 16 tháng 8 năm 1945, Trần Trọng Kim tuyên bố bảo vệ "độc lập" giành được 9 tháng 3, và ngày 18 tháng 8 tạo ra một ủy ban giải phóng dân tộc, bao gồm tất cả các đảng phái chính trị để lãnh đạo việc giành lại độc lập cho Việt Nam.[cần dẫn nguồn] Theo lời khuyên của ông Bộ trưởng Bộ Ngoại giao, Bảo Đại gửi thông điệp cho Tổng thống Truman, vua nước Anh, Thống chế Tưởng Giới Thạch, Tướng de Gaulle đề nghị công nhận độc lập của Việt Nam. Tuy nhiên đến 24 tháng 8 ông đã thực hiện câu trả lời Hội đồng Cơ mật quyết định thoái vị "để không phải là một trở ngại cho sự giải phóng của đất nước".[15]
Ngày 18 tháng 8 năm 1945, vua Bảo Đại đã xác nhận độc lập của Việt Nam sau khi Nhật đầu hàng, được công bố vào tháng 3 và đồng thời gửi một thông điệp đến De Gaulle yêu cầu công nhận nền độc lập của Việt Nam. Thông điệp này cho rằng sự độc lập của Việt Nam "chỉ có nghĩa là bảo vệ lợi ích của Pháp và ảnh hưởng tinh thần Pháp ở Đông Dương".[cần dẫn nguồn] Tuy nhiên De Gaulle dự kiến sẽ hậu thuẫn cho một chế độ quân chủ mà người đứng đầu không phải là Bảo Đại, người đã thỏa hiệp với Nhật Bản để được "độc lập", mà là Vĩnh San, được xem như là một người "Gaullist".[16]
Từ cuối tháng 9 năm 1945 quân đội Pháp núp dưới bóng quân Anh vào giải giáp vũ khí quân Nhật, đã quay trở lại miền Nam Việt Nam. Sự việc này nằm trong tính toán của chính quyền Charles de Gaulle khi Đại chiến thế giới II chưa kết thúc.
Ký kết Hiệp định sơ bộ Pháp-Việt
Trong thời gian đầu, Chính phủ Việt Nam Dân chủ Cộng hòa kiên quyết chống lại việc Pháp tái lập chủ quyền ở Đông Dương. Sau đó, theo quan điểm của Ban Thường vụ TW 3 Đảng cộng sản Đông Dương (đã lui vào hoạt động bí mật), tháng 3 năm 1946, nếu Pháp cho Đông Dương tự trị theo tuyên bố ngày 24 tháng 3 năm 1945 thì kiên quyết đánh, nhưng nếu cho Đông Dương tự chủ thì hòa để phá tan âm mưu của "bọn Tàu trắng, bọn phản động Việt Nam và bọn phát xít Nhật còn lại". Đến ngày 6 tháng 3, 1946, Chính phủ ký với Pháp Hiệp định sơ bộ Pháp-Việt 1946, cho phép quân đội Pháp ra Bắc thay thế quân Trung Hoa giải giáp quân đội Đế quốc Nhật Bản. Pháp hứa sẽ rút hết quân trong thời hạn 5 năm, mỗi năm rút 3.000 quân. Ngược lại, Chính phủ Pháp công nhận nước Việt Nam Dân chủ Cộng hòa là một quốc gia tự do trong Liên bang Đông Dương và trong khối Liên hiệp Pháp, có chính phủ, nghị viện, quân đội và tài chính riêng. Trước đó Pháp và Trung Hoa đã ra thỏa thuận tại Trùng Khánh (Hiệp ước Hoa -Pháp), đồng ý cho quân Pháp ra miền Bắc Việt Nam (28 tháng 2) nhưng khi quân Pháp đổ bộ vào Hải Phòng đã xung đột với quân Trung Hoa dân quốc và lực lượng quân sự địa phương của Việt Nam Dân chủ Cộng hòa.
Một số thành viên trong Chính phủ Liên hiệp thuộc Việt Quốc, Việt Cách... không tán thành việc này, đã lên tiếng phản đối, dân chúng cũng có người băn khoăn, nhưng Chủ tịch Hồ Chí Minh đã bình tĩnh giải thích và động viên đồng bào để đồng bào hiểu rõ "cần phải biết chịu đựng hy sinh để mưu sự nghiệp lớn"[17]. Mặc dù Hiệp định có chữ ký của Vũ Hồng Khanh nhưng đa số lãnh đạo Việt Quốc rút sự ủng hộ của họ cho chính phủ Hồ Chí Minh để phản đối, chống lại những gì họ gọi là "thân Pháp" trong chính sách của Việt Minh. Bảo Đại rời khỏi đất nước vào ngày 18 tháng 3, ngày quân Pháp vào Hà Nội. Một hội nghị liên tịch được tổ chức để khai thông các bất đồng dẫn đến việc thành lập Hội Liên hiệp Quốc dân Việt Nam[18].
Hiệp định Sơ bộ ấn định lực lượng Pháp sau khi trở ra Bắc, phải rút hết sau một thời gian hai bên quy định không quá 5 năm. Trong khi đó hai bên đình chiến. Nước Pháp cũng công nhận Việt Nam Dân chủ Cộng hòa là một nước tự do, có chính phủ, nghị viện, quân đội, tài chính riêng và là một thành viên trong Liên bang Đông Dương thuộc khối Liên hiệp Pháp. Vấn đề độc lập của Việt Nam bị gác sang một bên vì Pháp không muốn bàn tới.
Ký kết Tạm ước Việt - Pháp
- Địa vị của Việt Nam trong khối Liên hiệp Pháp, về quan hệ ngoại giao của Việt Nam.
- Quan niệm tổng quát về Liên bang Đông Dương.
- Vấn đề thống nhất nước Việt Nam và việc trưng cầu dân ý.
- Chi tiết về Liên bang Đông Dương và vấn đề quyền lợi kinh tế của Pháp ở Đông Dương.
- Dự thảo Hiệp ước.
- Việc thống nhất Nam Kỳ vào nước Việt Nam Dân chủ Cộng hòa (bao gồm Bắc Kỳ và Trung Kỳ).
- Độc lập chính trị của Việt Nam Dân chủ Cộng hòa.
Tuy nhiên Hồ Chí Minh và Bộ trưởng Bộ Thuộc địa Pháp Marius Moutet không chấp nhận thất bại. Trong khi Phạm Văn Đồng bỏ về nước, Hồ Chí Minh, Hoàng Minh Giám và Dương Bạch Mai nán lại Paris. Nhằm cứu vớt hòa bình lần cuối Hồ Chí Minh thảo một bản nghị ước vào chiều ngày 11 và trao cho Marius Moutet.[23] Ba ngày sau, 14 tháng 9 năm 1946, Marius Moutet hồi đáp với một bản nghị ước khác. Đạt được đồng thuận, Hồ Chí Minh đã đến tư dinh của Marius Moutet lúc nửa đêm ngày 14 tháng 9 năm 1946 để ký văn bản này, tức Tạm ước Việt - Pháp (Modus vivendi).[20]
Ngày 14 tháng 9 năm 1946, Pháp và Chính phủ Việt Nam Dân chủ Cộng hòa ký Tạm ước Việt - Pháp (Modus vivendi). Trong bản Tạm ước này, hai bên Việt Nam Dân chủ Cộng hòa và Pháp cùng bảo đảm với nhau về quyền tự do của kiều dân, chế độ tài sản của hai bên; thống nhất về các vấn đề như: hoạt động của các trường học Pháp, sử dụng đồng bạc Đông Dương làm tiền tệ, thống nhất thuế quan và tái lập cải thiện giao thông liên lạc của Liên bang Đông Dương, cũng như việc thành lập ủy ban tạm thời giải quyết vấn đề ngoại giao của Việt Nam. Chính phủ Việt Nam cam kết ưu tiên dùng người Pháp làm cố vấn hoặc chuyên môn, và hai bên đã đồng ý chấm dứt mọi hành động xung đột, vũ lực cũng như tuyên truyền chống đối nhau, phóng thích tù nhân chính trị, bảo đảm không truy bức người của bên kia, và hợp tác để những kiều dân hai bên không làm hại nhau. Tạm ước cam kết sẽ có một nhân vật do Việt Nam chỉ định và Chính phủ Pháp công nhận được uỷ nhiệm cạnh thượng sứ để xếp đặt cộng tác thi hành những điều thoả thuận này. Cuối cùng, Chính phủ hai bên sẽ sớm tiếp tục đàm phán (chậm nhất là vào tháng 1 năm 1947) để tìm cách ký kết những bản thoả thuận riêng nhằm dọn đường cho một hiệp ước chung dứt khoát.[24][25]
Kêu gọi sự ủng hộ của các cường quốc
Ngoài ra, Chủ tịch Hồ Chí Minh còn gửi thư cho nhiều nguyên thủ quốc gia trên thế giới kêu gọi công nhận nhà nước Việt Nam mới được thành lập cũng như tranh thủ sự ủng hộ nhưng không nhận được hồi âm (Tổng thống Hoa Kỳ Harry Truman[26], lãnh tụ Liên Xô Stalin, Tổng thống Pháp Léon Blum, bộ trưởng Thuộc địa Pháp Marius Moutet và Nghị viện Pháp,…).Chiến tranh bùng nổ
Đầu tháng 11 năm 1946, xung đột quân sự đầu tiên nổ ra tại Hải Phòng do Pháp và Việt Nam Dân chủ Cộng hòa tranh chấp quyền kiểm soát tất cả các vấn đề liên quan đến xuất nhập khẩu. Hai ngày sau, Tướng Jean-Étienne Valluy, tổng chỉ huy quân đội Pháp ở Đông Dương, lệnh cho quân Pháp chiếm toàn quyền kiểm soát thành phố. Ngày 23 tháng 11, Đại tá Pierre Louis Dèbes gửi tối hậu thư yêu cầu người Việt ra khỏi khu phố Tàu của Hải Phòng và hạ vũ khí. Khi không có phản hồi, Dèbes lệnh cho tàu chiến Pháp bắn phá thành phố, trong một buổi chiều đã giết chết hơn 6.000 người dân[27] hoặc hơn 2.000 người theo một nguồn khác.[28]. Sau đó, khoảng 2.000 lính Pháp tràn vào thành phố trong khi pháo tiếp tục bắn phá vùng ngoại ô. Quân Pháp gặp phải hỏa lực mạnh của lực lượng Việt Minh bảo vệ thành phố. Chiến sự kéo dài cho đến khi người lính Việt Minh cuối cùng rút khỏi chiến trường vào ngày 28 tháng 11.Sau sự kiện Hải Phòng, kế hoạch phòng thủ Hà Nội bắt đầu được chuẩn bị để chính phủ Việt Nam có thời gian sơ tán về các vùng núi lân cận. Một số ít lực lượng chính phủ đóng tại Bắc Bộ phủ và một doanh trại gần đó. Còn phần lớn lực lượng quân sự của Việt Nam trong vùng đóng tại ngoại ô của thủ đô. Bù lại, trong nội thành có gần 10.000 du kích và tự vệ. Đối địch với họ là vài nghìn lính Lê dương Pháp.
Các cơ quan của chính phủ Việt Nam bí mật chuyển dần ra các địa điểm đã được chuẩn bị trước ở bên ngoài thành phố. Trong thành phố, quân dân Hà Nội bắt đầu xây dựng các chiến lũy phòng thủ trên đường phố, quân Pháp cũng củng cố các vị trí phòng thủ của mình. Ngày 6 tháng 12, Hồ Chí Minh kêu gọi Pháp rút về các vị trí họ đã giữ từ trước ngày 20 tháng 11, nhưng ông không nhận được phản hồi. Trả lời phỏng vấn của nhà báo Pháp vào hôm sau, Hồ Chủ tịch khẳng định rằng Chính phủ Việt Nam hy vọng tránh được chiến tranh - cái sẽ gây đau khổ lớn cho cả hai nước. "Nhưng nếu chúng tôi phải đối mặt với chiến tranh", ông nói, "chúng tôi sẽ chiến đấu chứ không từ bỏ quyền tự do của mình".
Ngày 12 tháng 12, Léon Brum, thủ tướng mới của Pháp tuyên bố ý định giải quyết xung đột ở Đông Dương theo cách sẽ trao lại độc lập cho Việt Nam. Ba ngày sau, Hồ Chí Minh đưa Sainteny một bức thông điệp gửi Brum với các gợi ý cụ thể về cách giải quyết xung đột. Sainteny đánh điện bức thông điệp vào Sài Gòn, yêu cầu chuyển tiếp tới Paris.
Trong khi chính phủ Pháp đang do dự về yêu cầu của Cao ủy Đông Dương Georges D'Argenlieu về việc tăng quân và lập tức hành động quân sự chống lại người Việt, Valluy, người có chung quyết tâm với d'Argenlieu về việc giữ sự hiện diện của Pháp tại Đông Dương, đã quyết định rằng cần phải khiêu khích Hà Nội nhằm tạo xung đột và đưa Paris vào sự đã rồi. Ngày 16 tháng 12, ông lệnh cho tướng Morlière phá các chướng ngại vật mà Việt Minh dựng trong thành phố. Khi bức điện của Hồ Chí Minh gửi Brum vào đến Sài Gòn, Vallue viết thêm bình luận của mình, cảnh báo rằng sẽ nguy hiểm nếu trì hoãn các hành động quân sự cho đến năm sau. Đến ngày 19, bức điện mới đến Paris, khi đó đã quá muộn.
Ngày 17 tháng 12, quân Pháp với xe tăng yểm trợ vào các đường phố Hà Nội để phá các công sự mà Việt Minh dựng trong những ngày trước đó, gây ra vụ thảm sát ở phố Hàng Bún (Hà Nội), rồi dàn quân ra chốt giữ từ cổng thành Hà Nội đến tận cầu Long Biên và bao vây gây sức ép đồn Công an quận 2 của Hà Nội. Người Việt không phản ứng. Hôm sau, Pháp ra một tối hậu thư đòi chấm dứt dựng chướng ngại vật trên phố. Chiều hôm đó, Pháp ra tối hậu thư thứ hai tuyên bố rằng từ ngày 20, quân Pháp sẽ tự mình đảm nhiệm việc trị an ở Hà Nội. Đáp lại, tối hôm đó, các lực lượng Việt Minh bắt đầu chặn mọi ngả đường từ ngoại ô vào thành phố. Sáng hôm sau (ngày 19 tháng 12), Pháp ra tối hậu thư thứ ba, đòi chính phủ Việt Nam đình chỉ mọi hoạt động chuẩn bị chiến tranh, tước vũ khí của Tự vệ tại Hà Nội, và trao cho quân đội Pháp việc duy trì an ninh trong thành phố.
Đối với người Việt, tình hình không khác với sự kiện Hải Phòng hồi tháng trước, khi Đại tá Dèbes cũng đã ra các lệnh tương tự trước khi bắn phá thành phố. Sáng ngày 18 tháng 12, Hồ Chủ tịch ra lệnh chuẩn bị cho các cuộc tấn công quân Pháp vào hôm sau. Đồng thời, sợ rằng bức điện gửi Thủ tướng Brum có thể chưa đến nơi, ông gửi một bức điện thẳng tới Paris. Sáng 19, để thể hiện thiện chí và cố gắng cứu vãn hòa bình, Hồ Chủ tịch viết một bức thư ngắn và cử cố vấn ngoại giao Hoàng Minh Giám tới gặp Sainteny để đàm phán "tìm giải pháp để cải thiện bầu không khí hiện tại". Sau khi được tin Sainteny từ chối gặp Hoàng Minh Giám, Hồ Chủ tịch triệu tập Hội nghị Thường vụ Trung ương Ðảng mở rộng tại làng Vạn Phúc, Hà Nội, và tuyên bố rằng trong tình hình hiện tại, không thể nhân nhượng thêm được nữa. Hội nghị duyệt lại Lời kêu gọi toàn quốc kháng chiến mà Hồ Chủ tịch đã viết, thông qua văn kiện "Toàn dân kháng chiến" do Tổng Bí thư Trường Chinh dự thảo. Thời điểm bắt đầu nổ súng được quyết định là 8 giờ tối cùng ngày. Chiến tranh Đông Dương bắt đầu.
Leclerc, người tham gia Hiệp định sơ bộ 6 tháng Ba, cũng đã điều tra sự cố dẫn đến xung đột tại miền Bắc Việt Nam và việc Việt Nam Dân chủ Cộng hòa tuyên bố kháng chiến khiến các giải pháp chính trị thất bại. Ngày 27 tháng Giêng năm 1947, tuyên bố của chính phủ Pháp về "Chi tiết các mục tiêu theo đuổi của Pháp ở Đông Dương" có nêu "để đạt được càng sớm càng tốt với các đại diện đủ điều kiện của người An Nam một thỏa thuận phù hợp với nguyện vọng chính đáng trong Liên hiệp Pháp (...) trên cơ sở độc lập của đất nước cùng với việc duy trì lợi ích của Pháp và sự hiện diện của (các) căn cứ chiến lược của lực lượng Pháp. Một hỗ trợ lớn và ngay lập tức phải nhằm củng cố chính quyền của Nam Kỳ, nhưng "phần nào đủ điều kiện" để không đóng cánh cửa đàm phán với Việt Minh." [29]
Giai đoạn 1947 - 1954
Giai đoạn 1955 - 1976
Ký kết Hiệp định Genève
Lập trường của Việt Nam Dân chủ Cộng hòa tại bàn đàm phán là: Pháp phải thừa nhận chủ quyền và độc lập của Việt Nam, Campuchia và Lào và rút quân đội khỏi 3 nước này; tiến hành tổng tuyển cử ở ba nước để thành lập các chính phủ thống nhất. Những cuộc tuyển cử trên phải được tiến hành với điều kiện tất cả các đảng phái và tổ chức yêu nước được tự do hoạt động dưới sự giám sát của các ủy ban địa phương. Nếu các điều kiện trên được chấp nhận chính phủ các nước Đông Dương đồng ý xem xét vấn đề gia nhập khối Liên hiệp Pháp. Việt Nam Dân chủ Cộng hòa đề nghị tham gia đàm phán có đại diện Chính phủ kháng chiến Lào, Campuchia nhưng các nước phương Tây từ chối.
Theo Hiệp định đã ký kết tất cả ba nước Đông Dưong phải đình chỉ chiến sự và rút quân đội các bên đến khu vực quy định. Theo Hiệp định Genève về Việt Nam, nước Việt Nam tạm thời bị chia thành hai vùng có giới tuyến là vĩ tuyến 17 trong 2 năm:
- Miền Bắc thuộc quyền kiểm soát của chính phủ Việt Nam Dân chủ Cộng hòa, thủ đô là Hà Nội, chủ tịch chính phủ là Hồ Chí Minh.
- Miền Nam thuộc quyền kiểm soát của Quốc gia Việt Nam đã tách khỏi khối Liên hiệp Pháp trước khi ký Hiệp định 6 tuần. Quân Pháp sẽ dần rút đi trong 2 năm. Năm 1955, Việt Nam Cộng hòa được thành lập từ Quốc gia Việt Nam sau khi Quốc hội Lập hiến ban hành Hiến pháp với thủ đô đặt tại Sài Gòn.
Ngay sau thời khắc chia đất nước ra làm hai vùng, đã diễn ra cuộc di cư lớn của gần 900.000 người dân miền Bắc, mà đa số là người Công giáo, vào miền Nam, với niềm tin "theo Chúa vào Nam". Một số người tin theo lời người Pháp cho rằng họ sẽ bị những chính sách của chính quyền miền Bắc bức hại bản thân họ. Khoảng 140 ngàn người khác ở miền Nam, gồm phần lớn là lực lượng kháng chiến của Việt Nam Dân chủ Cộng hòa tại miền Nam hoặc những người đi theo chủ nghĩa cộng sản, tập kết ra miền Bắc theo Hiệp định Genève. Theo như Bản tuyên bố cuối cùng của Hội nghị Genève, sẽ có một cuộc tổng tuyển cử ở cả hai miền sau hai năm để thống nhất đất nước.
Hỗ trợ tiến hành chiến tranh ở miền Nam
Với sự viện trợ của Liên Xô và Trung Quốc, Việt Nam Dân chủ Cộng hòa đã hỗ trợ người và của cho Mặt trận Dân tộc Giải phóng miền Nam Việt Nam để đối đầu với Hoa Kỳ và Việt Nam Cộng hòa suốt 16 năm (1959-1975), Việt Nam Dân chủ Cộng hòa luôn là hậu phương lớn của chiến trường miền Nam.
Trong thời Chiến tranh Việt Nam, lãnh thổ của Việt Nam Dân chủ Cộng hòa chịu nhiều tác hại của cuộc chiến vì các chiến dịch ném bom của quân đội Mỹ với mục đích ngăn chặn sự chi viện của hậu phương miền Bắc cho chiến trường miền Nam Việt Nam. Theo ước tính, không quân Hoa Kỳ đã ném xuống Việt Nam Dân chủ Cộng hòa khoảng 3 triệu tấn bom các loại.
Thống nhất hai miền Nam Bắc Việt Nam
Hành pháp
Cơ quan hành pháp của Việt Nam Dân chủ Cộng hoà được gọi là Chính phủ.Chính phủ Cách mạng Lâm thời
Thành lập
Sau khi Nhật đầu hàng đồng minh, Mặt trận Việt Minh thu hút nhiều đảng phái nhanh chóng cướp chính quyền từ tay chính phủ Trần Trọng Kim và lực lượng quân đội đế quốc Nhật Bản. Tại một số khu vực, khi mặt trận Việt Minh cướp chính quyền thì xảy ra xung đột với các các nhóm vũ trang của Đại Việt, Việt Nam Quốc dân Đảng do các bên đều cùng theo đuổi mục tiêu buộc Đế quốc Việt Nam bàn giao chính quyền cho họ.[31]Tổ chức chính quyền đầu tiên là Chính phủ Cách mạng Lâm thời, thành lập ngày 27 tháng 8, 1945 trên cơ sở Ủy ban Dân tộc Giải phóng Việt Nam do Việt Minh thành lập trong Cách mạng tháng Tám. Chính phủ Cách mạng Lâm thời tuyên bố "Chính phủ lâm thời không phải là Chính phủ riêng của Mặt trận Việt Nam độc lập đồng minh (Việt Minh) như có người đã lầm tưởng. Cũng không phải là một Chính phủ chỉ bao gồm đại biểu của các chính đảng. Thật là một Chính phủ quốc gia thống nhất, giữ trọng trách là chỉ đạo cho toàn quốc, đợi ngày triệu tập được Quốc hội để cử ra một Chính phủ Dân chủ Cộng hoà chính thức." đồng thời kêu gọi "Vận mệnh ngàn năm của dân tộc đang quyết định trong lúc này. Toàn thể quốc dân hãy khép chặt hàng ngũ, đứng dưới lá quốc kỳ, làm hậu thuẫn cho Chính phủ lâm thời, đặng nắm chắc tự do độc lập, cải tạo tổ quốc bấy nhiêu lâu đã bị bọn giặc nước tàn phá. Cuộc đấu tranh cho độc lập, tự do, hạnh phúc của dân tộc đang tiếp tục. Bước đường giải phóng dân tộc còn nhiều chông gai hiểm trở. Quốc dân hãy sẵn sàng nghe hiệu lệnh của Chính phủ, hy sinh phấn đấu bảo vệ quyền độc lập hoàn toàn.".[32] Cựu hoàng Bảo Đại và Giám mục Lê Hữu Từ được mời làm Cố vấn Tối cao Chính phủ Việt Nam Dân chủ Cộng hòa.
Hoạt động
Ngay sau khi thành lập, Chính phủ Cách mạng Lâm thời ban hành các sắc lệnh giải tán một số đảng phái[33][34], với lý do các đảng này "tư thông với ngoại quốc", làm "phương hại đến nền độc lập Việt Nam" (như Việt Nam Quốc xã, Đại Việt Quốc dân đảng...) nhằm kịp thời trừng trị "bọn phản cách mạng", "bảo vệ" chính quyền non trẻ đồng thời "giáo dục ý thức về tinh thần cảnh giác" cho nhân dân.[35] Cùng với đó là giải tán các nghiệp đoàn[36] để kiểm soát nền kinh tế[37], thống nhất các tổ chức thanh niên (vào Đoàn Thanh niên Cứu quốc Việt Nam). Đồng thời Chính phủ cũng ban hành sắc lệnh thành lập Hội đồng nhân dân và Ủy ban hành chính địa phương các cấp.Trong cuộc họp đầu tiên của Chính phủ Cách mạng Lâm thời (3/9/1945), toàn bộ các thành viên trong chính phủ đã thống nhất các phương pháp Chủ tịch chính phủ Hồ Chí Minh để giải quyết các vấn đề cấp bách của nước mới, bao gồm[38]:
- Phát động tăng gia sản xuất, mở các cuộc lạc quyên để chống nạn đói.
- Mở phong trào chống nạn mù chữ.
- Tổ chức càng sớm càng tốt cuộc tổng tuyển cử với chế độ phổ thông đầu phiếu, thực hiện các quyền tự do dân chủ cho nhân dân.
- Mở phong trào giáo dục cần, kiệm, liêm, chính, bài trừ các tệ nạn do chế độ thực dân để lại.
- Xóa bỏ các thứ thuế vô lý, trước mắt là thuế thân, thuế chợ, thuế đò; tuyệt đối cấm hút thuốc phiện.
- Tuyên bố tự do tín ngưỡng và lương giáo đoàn kết.
Để giải quyết tận gốc nạn đói, Chính phủ Cách mạng lâm thời Việt Nam Dân chủ Cộng hòa kêu gọi nhân dân tăng gia sản xuất. Chính phủ còn vận động tư nhân cho mượn các vườn trống quanh nhà để tăng gia sản xuất. Mỗi địa phương lập ra một tiểu ban để huy động nhân lực và tổ chức sản xuất, lương thực làm ra được dùng để cứu tế. Cuối năm 1945 đầu 1946 không còn kịp thời vụ để trồng lúa nữa, nên chính phủ phát động dành phần lớn đất đai để tranh thủ trồng liên tiếp hai vụ màu (khoai lang, đậu, bắp ...) bù cho phần lúa thiếu hụt. Kết quả sản lượng màu đã tăng gấp 4 lần so với thời kỳ trước năm 1945. Chỉ trong 5 tháng từ tháng 11/1945 đến tháng 5/1946 đã đạt 614.000 tấn, tương đương 506.000 tấn lúa, đủ đắp được số thiếu hụt của vụ mùa năm 1945.[39]
Trong năm 1946, nạn đói cơ bản đã được giải quyết. Ngày 2/9/1946, Bộ trưởng Bộ Nội vụ Võ Nguyên Giáp tuyên bố: “Cuộc cách mạng đã chiến thắng được nạn đói, thật là một kỳ công của chế độ dân chủ”. Giáo sư kinh tế Đặng Phong đánh giá việc giải quyết được nạn đói là lý do giải thích tại sao tuyệt đại đa số dân chúng đã tin và đi theo Việt Minh.[39]
Một thành tựu khác của chính quyền Việt Nam Dân chủ Cộng hòa non trẻ là xóa mù chữ. Năm 1945, có 95% dân số Việt Nam mù chữ. Trước thực trạng đó, để xóa mù chữ, từ ngày 8 tháng 9 năm 1945 Chủ tịch Hồ Chí Minh ra các sắc lệnh: Sắc lệnh số 17 đặt ra một bình dân học vụ trong toàn cõi Việt nam, Sắc lệnh số 19 lập cho nông dân và thợ thuyền những lớp học bình dân buổi tối, Sắc lệnh số 20 định rằng việc học chữ quốc ngữ từ nay bắt buộc và không mất tiền. Để phục vụ chiến dịch xoá mù chữ, Nha Bình dân học vụ được thành lập ngày 18 tháng 9 năm 1945. Ngày 4 tháng 10 năm 1945, Chủ tịch Hồ Chí Minh ra lời kêu gọi Chống nạn thất học gửi tới toàn dân: "...Muốn giữ vững nền độc lập, muốn làm cho dân mạnh nước giàu, mọi người Việt nam phải hiểu biết quyền lợi của mình, bổn phận của mình, phải có kiến thức, mới có thể tham gia vào công cuộc xây dựng nước nhà và trước hết phải biết đọc, biết viết chữ quốc ngữ. Những người đã biết chữ hãy dạy cho những người chưa biết chữ, hãy góp sức vào bình dân học vụ…Những người chưa biết chữ hãy gắng sức mà học cho biết đi." Các lớp học Bình dân học vụ được mở khắp nơi ở cả ba miền thu hút sự tham gia của mọi lứa tuổi, mọi tầng lớp nhân dân. Người biết chữ dạy cho người không biết chữ. Đến tháng 9 năm 1946, phong trào Bình dân học vụ đã tổ chức được 75.000 lớp học với trên 95.000 giáo viên, trên 2.500.000 người được phong trào dạy biết đọc, biết viết.[40]
Theo Quyết nghị của Chính phủ, ngày 4/9/1945, Bộ trưởng Bộ Nội vụ Võ Nguyên Giáp thay mặt Chủ tịch Chính phủ lâm thời nước Việt Nam Dân chủ Cộng hoà, ký ban hành Sắc lệnh số 4 lập "Quỹ độc lập" với mục đích "để thu nhận các món tiền và đồ vật của nhân dân sẵn lòng quyên giúp Chính phủ để ủng hộ nền độc lập của Quốc gia". Tiếp sau đó, cũng trong khuôn khổ Quỹ độc lập, Chính phủ đã đề ra biện pháp tổ chức "Tuần lễ Vàng” từ ngày 17 đến ngày 24/9/1945.[41] Chủ tịch Hồ Chí Minh đã gửi thư cho đồng bào toàn quốc nhân dịp "Tuần lễ Vàng”, nêu rõ mục đích của việc lập quỹ là "thu góp số vàng trong nhân dân và nhất là của các nhà giàu có để dùng vào việc cần cấp và quan trọng nhất của chúng ta lúc này là việc quốc phòng”. Chính phủ đã huy động được tổng cộng 20 triệu đồng và 370kg vàng.[42] Ngân quỹ quốc gia đã có hàng trăm triệu đồng. Riêng tại Hà Nội, trong “Tuần lễ vàng" nhân dân đã góp được 2.201 lạng vàng, 920 tạ thóc cùng tiền bạc và các hiện vật khác, tổng trị giá lên 7 triệu đồng Đông Dương.[43] Số tiền này được dùng để mua vũ khí của quân đội Nhật bị quân đội Trung hoa Dân quốc tịch thu và để hối lộ cho các tướng lĩnh Trung Hoa đang đóng quân tại miền Bắc Việt Nam.[44]
Cùng các hình thức tổ chức "Quỹ độc lập", tuần lễ vàng chính quyền cách mạng còn tổ chức nhiều hình thức khuyến khích để nhân dân có điều kiện tham gia đóng góp cho tài chính đất nước với hình thức tự nguyện như lập "Quỹ kháng chiến", “Quỹ bình dân học vụ”, "Quỹ giải phóng quân", “Ngày Nam Bộ"... Sự đóng góp, ủng hộ nhiệt tình của nhân dân đã góp phần giải quyết khó khăn về tài chính của Việt Nam Dân chủ Cộng hòa.
Chính phủ Liên hiệp Lâm thời
Thành lập
Tháng 9 năm 1945, 20 vạn quân Trung Hoa Dân Quốc gồm 4 quân đoàn do tướng Lư Hán làm tổng chỉ huy, theo sự phân công của phe Đồng Minh chia làm hai đường tiến vào miền Bắc giải giáp quân Nhật đã kéo vào đóng quân ở Hà Nội và hầu hết các thành phố, thị xã từ biên giới Việt-Trung đến vĩ tuyến 16. Quân của Tưởng Giới Thạch ngoài nhiệm vụ giải giáp quân Nhật còn nhằm thực hiện ý đồ tiêu diệt Đảng Cộng sản Đông Dương, phá tan mặt trận Việt Minh, giúp các lực lượng đối lập đánh đổ chính quyền do Việt Minh thành lập, thiết lập chính quyền thân Tưởng.[45]Các tổ chức Việt Quốc (Vũ Hồng Khanh, Nguyễn Tường Tam đứng đầu), Việt Cách (đứng đầu là Nguyễn Hải Thần) cũng nhanh chóng từ Trung Quốc đi cùng quân Tưởng trở về Việt Nam. Thành phần các đảng phái này trong nước không mạnh như Việt Minh.[31][46]
Theo đại tướng Võ Nguyên Giáp, mục đích của Việt Quốc, Việt Cách để mở đường, tạo dựng cơ sở cho Quân đội Trung Hoa Dân quốc vào Việt Nam[38], gây xung đột vũ trang với Quân giải phóng và cướp chính quyền các địa phương[45][47] Dựa vào quân đội Tưởng, Việt Quốc và Việt Cách đã chiếm giữ một số nơi ở Yên Bái, Vĩnh Yên, Móng Cái, liên tục thực hiện các vụ quấy nhiễu, cướp phá, giết người, rải truyền đơn, ra báo Việt Nam, Thiết Thực, Đồng Tâm nhằm vu cáo nói xấu Việt Minh, chống chính quyền Việt Nam Dân chủ Cộng hòa và đòi gạt bỏ các bộ trưởng là đảng viên cộng sản ra khỏi chính phủ mới thành lập.[45] Cũng theo Đại tướng Võ Nguyên Giáp, do sống từ lâu ở nước ngoài, lại không có liên hệ gì với phong trào cách mạng trong nước, nên Việt Quốc, Việt Cách không nhận được sự ủng hộ của người dân. Tại nhiều nơi có quân Tưởng và Việt Quốc, Việt Cách đi qua; các cơ quan chính quyền, đoàn thể, lực lượng vũ trang đều dãn ra xung quanh tránh xô xát lớn. Nhân dân thực hiện "vườn không, nhà trống". Điều này đã khiến cho quân Tưởng gặp nhiều khó khăn trên đường đi, còn Việt Quốc, Việt Cách cũng thất bại trong việc khuếch trương thanh thế cũng như mục đích của mình.[48] Còn theo sử gia Trần Trọng Kim Việt Quốc, Việt Cách tuy có thế lực nhờ quân đội Trung Hoa Dân Quốc hỗ trợ, nhưng không thống nhất và không có kỷ luật chặt chẽ,[49] tuyên truyền nhiều mà không làm được việc gì đáng kể[50]. Thiếu tá Mỹ thuộc OSS, Al Patti nhận xét những người Quốc gia lưu vong chống cộng quyết liệt, có tham vọng nắm quyền lãnh đạo đất nước nhưng quá kém về tổ chức, thiếu sự liên kết chính trị, thiếu lãnh đạo và không có một chương trình hành động ra hồn mà chỉ hy vọng tạo ra một nước Việt Nam độc lập với sự giúp đỡ của Trung Quốc.[51] Sau khi thảo luận với các lãnh đạo Việt Cách và Việt Nam Quốc dân Đảng, ông nhận thấy những người này tuyệt nhiên không có ý tưởng nào về việc đáp ứng nhu cầu của nhân dân, không một ai có khái niệm về công việc sẽ làm mà chỉ chăm chăm mục tiêu "chia sẻ quyền lực với Việt Minh". Ông ta nhận xét: "Họ (Việt Cách, Việt Nam Quốc dân Đảng) là những kẻ lạc hướng về chính trị, có lẽ vì sống quá lâu ở Trung Quốc".[52]
Tưởng Giới Thạch không có ý định dính líu vào cuộc đấu tranh giành độc lập của Việt Nam. Ông không muốn làm mất lòng Pháp vì Pháp là một cường quốc trong khối Đồng Minh. Ông chủ trương rút hết quân về nước ngay sau khi giải giáp Nhật. Ngược lại tướng Lư Hán xem lập trường của Tưởng là thiển cận vì đi ngược lại các nguyên tắc của Hiến chương Đại Tây Dương đã được Trung Hoa Dân Quốc cam kết ủng hộ. Lư Hán chủ trương đóng quân tại miền Bắc Việt Nam lâu dài, đặt Việt Nam dưới sự bảo trợ của Trung Hoa Dân Quốc để Việt Nam có thể độc lập mà không cần đến sự ủng hộ của Pháp. Trong suốt thời gian đóng quân tại miền Bắc Việt Nam, Lư Hán dùng mọi khả năng của mình để làm thất bại mọi kế hoạch của Pháp giành lại quyền kiểm soát miền Bắc Việt Nam.[53] Người Pháp được đối xử như những người ngoại quốc khác, Pháp không được cử đại diện tham gia vào lễ đầu hàng của Nhật với tư cách một nước trong khối Đồng Minh, các chỉ huy Pháp tại Hà Nội cũng không được Lư Hán công nhận là đại diện của chính phủ De Gaulle. Bộ phận OSS của Mỹ tại miền Bắc Việt Nam cũng từ chối giúp các chỉ huy Pháp thiết lập một hành dinh tại Việt Nam.[54] Trước đó OSS đã được lệnh của Tổng thống Mỹ Franklin D. Roosevelt không để cho Pháp tái chiếm Đông Dương, không được cung cấp vũ khí hay tiếp tế cho Pháp ngoại trừ để thực hiện những mục tiêu chống Nhật đã được Đồng Minh tán thành.[55]
Việt Nam Quốc dân Đảng và Đại Việt Quốc dân Đảng ủng hộ quan điểm của Lư Hán về việc Trung Quốc đóng quân lâu dài tại Việt Nam để hỗ trợ cho nền độc lập của Việt Nam còn Việt Cách lại ủng hộ quan điểm của Tưởng Giới Thạch rút hết quân đội Trung Hoa Dân Quốc về nước sau khi giải giáp Nhật để Nguyễn Hải Thần lãnh đạo Việt Nam với sự hỗ trợ của Trung Hoa Dân Quốc.[56]
Trong hai ngày 18 và 19 tháng 9 năm 1945, Việt Minh họp bí mật với Việt Cách (ngày 18/9/1945) và Đại Việt (ngày 19/9/1945). Trong hai cuộc họp này, Nguyễn Hải Thần đại diện Việt Cách và Nguyễn Tường Tam đại diện Đại Việt Quốc dân Đảng đề nghị Hồ Chí Minh đồng ý hợp nhất Việt Minh với Việt Cách và Đại Việt Quốc dân Đảng. Đối với lời đề nghị này, trong nội bộ Việt Minh có nhiều ý kiến khác nhau. Võ Nguyên Giáp không đồng ý vì cho rằng những đề nghị đó không có giá trị và không thật thà, chẳng khác gì thay thế chủ nghĩa thực dân Pháp bằng ách thống trị của Trung Quốc nhưng Hoàng Minh Giám lại nghĩ rằng việc hợp nhất Việt Minh với các đảng phái Quốc gia sẽ làm giảm bớt sự đối lập và tăng cường thế lực cho Việt Minh, làm người Trung Quốc yên lòng còn Pháp phải lo ngại, quan trọng nhất là Chính phủ Việt Nam Dân chủ Cộng hòa trong con mắt của Đồng Minh, đặc biệt là Mỹ, là chính phủ thật sự dân chủ. Cuối cùng Việt Minh đã từ chối hợp nhất với Việt Cách và Đại Việt Quốc dân Đảng.[57]
Điều làm Hồ Chí Minh lo ngại là trong một số giới, đặc biệt là tầng lớp trung lưu Việt Nam, người ta vẫn xem ông và Việt Minh là cộng sản vì thế ông phải làm mọi cách để thay đổi điều này[58]. Tháng 11 năm 1945, ông quyết định cho Đảng Cộng sản Đông Dương tự giải tán. Về mặt công khai, đảng của ông không còn hiện diện mà chỉ có một bộ phận hoạt động dưới danh nghĩa Hội nghiên cứu chủ nghĩa Mác ở Đông Dương[59].
Ngày 19 tháng 11 năm 1945, tướng Tiêu Văn đứng ra tổ chức một cuộc hội nghị hòa giải có Việt Nam Quốc dân Đảng, Việt Nam Cách mạng Đồng minh hội và Việt Minh tham gia. Mặt trận Việt Minh đồng ý nhượng bộ với Việt Quốc, Việt Cách.[31][60] Lãnh đạo Việt Cách Nguyễn Hải Thần được bổ nhiệm vào ghế Phó Chủ tịch Chính phủ. Đồng thời hai ghế bộ trưởng Bộ Y tế và Bộ Vệ sinh, một ghế thứ trưởng Bộ Quốc dân Kinh tế được giao cho các thành viên của Việt Quốc, Việt Cách.[61][62] Tuy nhiên chức trách các Bộ cũng thay đổi. Bộ trưởng Quốc phòng trở thành người lo về tài chính mà không được xem xét danh sách nhân sự, quân số, súng đạn còn các Bộ trưởng khác của các đảng phái Quốc gia chẳng có chức trách cụ thể gì, không bao giờ được tham dự bất cứ buổi họp nào của nội các.[63]
Ngày 1 tháng 1 năm 1946 Chính phủ Liên hiệp Lâm thời được thành lập thay thế Chính phủ Cách mạng Lâm thời với sự tham gia của một số đảng phái đối lập (Việt Cách, Việt Quốc...) hoạt động ở Trung Quốc với sự bảo trợ của Trung Hoa Quốc Dân Đảng.[64]
Hoạt động
Ngày 6 tháng 1 năm 1946, Chính phủ Liên hiệp Lâm thời do Chủ tịch Hồ Chí Minh đứng đầu đã tổ chức cuộc Tổng tuyển cử trên toàn quốc, lần đầu tiên đã bầu Quốc hội và thông qua Hiến pháp. Nhiều đảng phái không có quyền tham gia Tổng tuyển cử đã tìm cách phá hoại[65]. Các đảng này cho là trúng cử chỉ là Việt Minh cộng sản, chính quyền trong tay nên Việt Minh muốn ai trúng cũng được[66]. Mặc dù bị nhiều đảng phái tuyên truyền vận động dân chúng tẩy chay cuộc bầu cử và ngăn cản việc tổ chức bầu cử ở một số nơi, nhưng tại các địa phương, ở đâu cũng có người tự ứng cử, các cuộc tiếp xúc tranh cử công khai, tự do diễn ra ở khắp mọi nơi.[67] Theo Việt Minh, cuộc bầu cử diễn ra công bằng[67]. Tuy nhiên, lá phiếu không bí mật[68] và theo quan sát của sử gia Trần Trọng Kim[69] thì có nơi người dân bị cưỡng bách bầu cho Việt Minh.[70]Sau khi kết quả bầu cử được công bố, sự thật hoàn toàn không như các đảng phái tuyên truyền. Nhiều đại biểu có uy tín của các giai cấp, tầng lớp, tôn giáo, dân tộc đều trúng cử tại Quốc hội khóa I hầu hết chưa là đảng viên.[67]
Sau cuộc bầu cử, theo thỏa thuận với Việt Minh, phe đối lập bao gồm một số tổ chức như Việt Nam Cách mạng Đồng minh hội và Việt Nam Quốc dân Đảng được Trung Hoa Dân quốc ủng hộ, không tham gia Tổng tuyển cử nhưng vẫn được nắm 70 ghế Quốc hội cùng nhiều vị trí trong chính quyền trung ương do chính sách hòa hợp các đảng phái của Chính phủ. Trong hồi ký Những năm tháng không thể nào quên, đại tướng Võ Nguyên Giáp nhận định các đảng phái này lo sợ thất bại trước sức ủng hộ lớn của cử tri với mặt trận Việt Minh nên không tham gia bầu cử.[71]
Tại kỳ họp thứ nhất Quốc hội, theo đề nghị của đoàn chủ tịch (Ngô Tử Hạ điều khiển, với Nguyễn Đình Thi làm thư ký, các ghế Quốc hội phân chia tả hữu, theo đó Việt Quốc, Việt Cách (cánh hữu) ngồi bên tay phải, và các đại biểu Việt Minh, Marxist, Xã hội, Dân chủ ngồi bên tay trái, nhưng theo ý kiến của chủ tịch Hồ Chí Minh thì không nên phân chia như vậy, thể hiện một sự đoàn kết trong Quốc hội.
Chính phủ Liên hiệp Kháng chiến
Thành lập
Sau khi Quốc hội được bầu, ngày 2 tháng 3 năm 1946, Chính phủ Liên hiệp Kháng chiến được thành lập để thay thế Chính phủ Liên hiệp Lâm thời. Ở các địa phương, các cấp chính quyền liên hiệp được thành lập trong năm 1946.Hoạt động
Trong thời gian hoạt động, Chính phủ đã tiếp tục thực hiện các biện pháp, chính sách để giữ vững nền độc lập của nước Việt Nam dân chủ non trẻ. Về đối nội đã kêu gọi các đảng phái đoàn kết phụng sự quốc gia, thực hiện các chính sách kinh tế, quốc phòng, văn hóa, giáo dục...[72] Hồ Chí Minh giao cho Võ Nguyên Giáp và Trần Quốc Hoàn, sau này trở thành Bộ trưởng Công an, nhiệm vụ vô hiệu hóa các cuộc biểu tình do Việt Nam Quốc dân Đảng và Việt Nam Cách mệnh Đồng minh Hội tổ chức nhằm chấm dứt hoạt động tuyên truyền của các đảng này trong dân chúng. Võ Nguyên Giáp kể lại: "Chúng tôi phải trừng trị bọn phá hoại... Nhưng bằng mọi giá phải tránh khiêu khích và đảm bảo không xảy ra xung đột lớn". Võ Nguyên Giáp dùng lực lượng tự vệ và các hội viên Hội Cứu Quốc phá các cuộc biểu tình này. Khi có lộn xộn, lính Trung Quốc bắn chỉ thiên, xông vào giải tán đám biểu tình để vãn hồi trị an. Việt Nam Quốc dân Đảng hoảng hốt khi người Trung Hoa không giúp được gì nhiều trong việc chống lại Việt Minh như họ mong đợi. Ông Nguyễn Duy Thanh, một người theo chủ nghĩa quốc gia buồn rầu nhớ lại: "Không có Trung Hoa ủng hộ, những đảng phái theo chủ nghĩa quốc gia chẳng thể đối phó được với những người Cộng sản"[73]Về đối ngoại đã thực hiện đàm phán với Chính phủ Pháp, ký với đại diện chính phủ Cộng hòa Pháp J. Sainteny bản Hiệp định sơ bộ Pháp-Việt ngày 6 tháng 3 năm 1946 cho phép 15.000 quân Pháp ra Bắc thay thế cho 20 vạn quân Tưởng rút về nước. Sau khi bản Hiệp định sơ bộ Pháp-Việt được ký ngày 6 tháng 3 năm 1946, các đảng phái không cộng sản và thân nước ngoài như Việt Quốc và Việt Cách đã lên tiếng phản đối Chính phủ ký hiệp định này với Pháp.
Từ ngày 19 tháng 4 đến ngày 11 tháng 5 năm 1946 tại Đà Lạt, chính phủ tổ chức một hội nghị dự bị, gặp gỡ giữa 2 phái đoàn Việt và Pháp chuẩn bị cho Hội nghị Fontainebleau chính thức vào tháng 7 năm 1946.
Ngày 31 tháng 5 năm 1946, Chủ tịch Hồ Chí Minh lên đường sang Pháp theo lời mời của chính phủ nước này. Cùng ngày, phái đoàn chính phủ do Phạm Văn Đồng dẫn đầu cũng khởi hành. Trước khi đi, Hồ Chí Minh bàn giao quyền lãnh đạo đất nước cho quyền chủ tịch nước là cụ Huỳnh Thúc Kháng với lời dặn "Dĩ bất biến, ứng vạn biến". Trước khi lên đường sang Pháp, Hồ Chí Minh dự đoán thời gian ở Pháp "...có khi một tháng, có khi hơn"[74] nhưng cuối cùng Chủ tịch Hồ Chí Minh ở Pháp 4 tháng trong lúc phái đoàn do Phạm Văn Đồng dẫn đầu tham dự Hội nghị Fontainebleau (diễn ra từ 6 tháng 7 tới 10 tháng 9 năm 1946). Hội nghị Fontainebleau không đem lại kết quả cụ thể nào. Sau khi phái đoàn của Việt Nam về nước, tại Pháp, ngày 14 tháng 9 năm 1946, Chủ tịch Hồ Chí Minh ký với đại diện Pháp bản Tạm ước Việt - Pháp.
Ngày 15/6/1946, người lính cuối cùng của quân đội Trung Hoa Dân Quốc rời khỏi Việt Nam[75]. Các thành viên Việt Nam Quốc dân Đảng và Việt Nam Cách Mệnh Đồng minh hội mất chỗ dựa hậu thuẫn chính là quân đội Tưởng Giới Thạch và do bất đồng về việc ký Hiệp định sơ bộ Pháp-Việt mùng 6 tháng 3 đã lần lượt rút khỏi chính phủ Liên hiệp.[cần dẫn nguồn] Lãnh tụ đảng Việt Cách là Nguyễn Hải Thần và các thành viên Việt Quốc - Việt Cách khác trong chính phủ như Nguyễn Tường Tam, Vũ Hồng Khanh và cánh thân Tưởng do Vũ Hồng Khanh lãnh đạo lưu vong sang Trung Quốc. Các đảng viên Đại Việt phần lớn vẫn ở lại Việt Nam chờ thời cơ.[76]. Nguyễn Tường Tam với tư cách Bộ trưởng Bộ ngoại giao dẫn đầu phái đoàn Việt Nam Dân chủ Cộng hòa tham gia Hội nghị trù bị tại Đà Lạt, nhưng do bất đồng đã không tham gia hầu hết các phiên họp[77], sau đó cũng không tham gia Hội nghị Fontainebleau, cuối cùng rời bỏ chính phủ[78] (tài liệu nhà nước nêu Nguyễn Tường Tam thiếu bản lĩnh chính trị, lập trường bấp bênh, biển thủ công quỹ rồi đào nhiệm sang nước ngoài[79]). Việc các thành viên chủ chốt của Việt Quốc, Việt Cách như Nguyễn Hải Thần, Nguyễn Tường Tam, Vũ Hồng Khanh rời bỏ chính phủ, lưu vong sang Trung Quốc đã đánh dấu chấm hết cho thời kỳ hợp tác giữa Việt Minh và các đảng phái không cộng sản tại miền Bắc, trong công cuộc "kháng chiến kiến quốc" mà Chính phủ Liên hiệp Kháng chiến là biểu tượng.
Trong lúc đó, Võ Nguyên Giáp vội vã từng bước tìm cách loại bỏ dần các đảng phái đối lập như Việt Quốc, Việt Cách, Đại Việt, những người Trotskist, lực lượng chính trị Công giáo... Ngày 19/6/1946, Báo Cứu Quốc của Tổng bộ Việt Minh đăng xã luận kịch liệt chỉ trích "bọn phản động phá hoại Hiệp định sơ bộ Pháp Việt mùng 6 tháng 3". Ngay sau đó Võ Nguyên Giáp bắt đầu chiến dịch truy quét các đảng phái đối lập bằng lực lượng công an và quân đội do Việt Minh kiểm soát với sự giúp đỡ của nhà cầm quyền Pháp. Ông cũng sử dụng các sỹ quan Nhật Bản trốn tại Việt Nam và một số vũ khí do Pháp cung cấp cho chiến dịch này.[75]
Một trong những sự kiện nổi tiếng nhất trong chiến dịch tiêu diệt các đảng phái đối lập là vụ án phố Ôn Như Hầu. Sau khi từ Trung Quốc về Việt Nam, Việt Nam Quốc dân Đảng ngoài việc tìm cách lật đổ Việt Minh để cùng với các đảng phái Việt Cách, Đại Việt... chiếm chính quyền.[80] Việt Nam Quốc dân Đảng và Đại Việt Quốc dân đảng nhờ có vũ khí do Trung Hoa Dân Quốc chuyển giao còn tổ chức các đội vũ trang mang tên "Thần lôi đoàn", "Thiết huyết đoàn", "Hùm xám"... Các đội vũ trang này đã tổ chức nhiều vụ cướp có vũ trang, bắt cóc, tống tiền, tổ chức ám sát những người theo Việt Minh và cả những người trung lập như ông Ba Viên rồi tuyên truyền đổ lỗi cho Việt Minh đã không đảm bảo được an ninh trật tự ở Hà nội và một số đô thị ở Bắc Bộ.[81] Không những thế đầu tháng 6 năm 1946, Việt Nam Quốc dân Đảng tổ chức cho Nghiêm Xuân Chi (đảng viên Việt Quốc) ám sát một số lãnh đạo của Việt Minh như Võ Nguyên Giáp, Trường Chinh và ông Bồ Xuân Luật, một người cũ của Việt Cách nay đứng về phe Việt Minh.[82] Trước những hoạt động gây mất trật tự an ninh tại Hà Nội và một số thành phố ở Bắc Bộ, Sở Công an Bắc Bộ đã lập chuyên án mà sau này được lấy tên công khai là Chuyên án số 7 phố Ôn Như Hầu[81]
Ngày 12/7/1946, Việt Nam Công an vụ theo ý kiến chỉ đạo của Trường Chinh (Tổng Bí thư Đảng Cộng sản Đông Dương, khi đó rút vào hoạt động bí mật. Chức danh công khai là Hội trưởng Hội nghiên cứu Chủ nghĩa Mác ở Đông Dương)[83], đã thực hiện phá vụ án phố Ôn Như Hầu. Chỉ đạo trực tiếp lực lượng công an phá vụ án này là các ông Lê Giản (Giám đốc Nha Công an Bắc bộ), Nguyễn Tuấn Thức (Giám đốc Công an Hà Nội) và Nguyễn Tạo (Trưởng nha Điệp báo Công an Trung ương).[84] Lực lượng công an xung phong đã thực hiện khám xét các trụ sở Việt Nam Quốc dân Đảng tại Hà Nội, bắt tại chỗ nhiều thành viên của Việt Nam Quốc dân Đảng cùng nhiều tang vật như truyền đơn, vũ khí, dụng cụ tra tấn, đồng thời phát hiện nhiều xác chết tại đó... Trong số các thành viên của Quốc dân Đảng bị bắt có một đại biểu Quốc hội Việt Nam khóa I là Phan Kích Nam. Theo điều tra của Nha công an, Việt Nam Quốc dân Đảng đang chuẩn bị những hành động khiêu khích rất nghiêm trọng. Dự định các thành viên của Việt Nam Quốc dân Đảng sẽ phục sẵn dọc đường quân Pháp diễu qua nhân ngày quốc khánh Pháp, bắn súng, ném lựu đạn để tạo ra những chuyện rắc rối giữa Pháp và Chính phủ, gây sự phá hoại hòa bình rồi tung truyền đơn hô hào lật đổ chính quyền và sau đó đứng ra bắt tay với Pháp.[76]
Trong ngày 12/7/1946, một tiểu đội công an do Lê Hữu Qua chỉ huy[85] bao vây khám xét trụ sở của đảng Đại Việt tại số 132 Duvigneau, do nghi ngờ Đại Việt cấu kết với Pháp âm mưu tiến hành đảo chính chính quyền cách mạng đúng vào ngày quốc khánh Pháp 14/7/1946.[84] Khi thực hiện cuộc bao vây khám xét này, lực lượng công an chưa có chứng cứ cụ thể và chưa có lệnh của cấp trên. Nhưng vẫn thực hiện bao vây khám xét để các thành viên Đại Việt không có thời gian rút vào bí mật và tẩu tán truyền đơn, hiệu triệu lật đổ chính quyền. Lực lượng công an đột kích bất ngờ vào sáng sớm khiến cho lính canh và các đảng viên Đại Việt không kịp có hành động trở tay.[85] Tại trụ sở của Đại Việt, lực lượng công an đã tìm thấy nhiều truyền đơn, hiệu triệu chưa kịp tẩu tán cùng nhiều súng ống, lựu đạn.
Ngày 16 tháng 7, quyền chủ tịch nước Huỳnh Thúc Kháng đã có tuyên bố trấn an dư luận: "Những đảng viên Việt Nam Quốc dân Đảng chân chính, được bảo đảm sự tự do hoạt động trong vòng pháp luật...Những kẻ bắt cóc, tống tiền, ám sát thì phải đem ra pháp luật nghiêm trị. Đây không phải là vấn đề đảng phái. Việc khám xét vừa rồi là việc phải làm để bảo vệ trị an...".[86]
Theo quy định của luật pháp thì Phó Chủ tịch nước và bộ trưởng do Quốc hội bầu, và chỉ phế truất bởi Quốc hội theo thủ tục quy định của pháp luật.[87] Trong phiên điều trần trước Quốc hội kỳ họp thứ hai liên quan Tạm ước và một số thành viên rời Chính phủ, Hồ Chí Minh có nói:
Tạm ước này có ảnh hưởng tới các hiệp ước ký sau không? Trong xã hội loài người, có cái gì mà không ảnh hướng tới cái khác. Tuy vậy, những sự điều đình sau đây không thể vì bản tạm ước này mà bị ràng bó. Bản Tạm ước này tùy theo sự thi hành thế nào, sẽ tạo điều kiện đẩy cho những cuộc điều đình sau mau chóng đạt kết quả.Về ông Phó Chủ tịch Nguyễn Hải Thần, ông Bộ trưởng Ngoại giao Nguyễn Tường Tam, ông Phó Chủ tịch Quân ủy hội Vũ Hồng Khanh, các ông ấy không có mặt ở đây. Lúc Nhà nước đương gặp bước khó khăn, quốc dân tin ở người nào trao người ấy làm công việc lớn mà các ông ấy lại bỏ đi thì các ông ấy phải hỏi lương tâm thế nào? Những người đã bỏ việc đi kia, họ không muốn gánh vác việc nước nhà hoặc họ cũng không đủ năng lực gánh vác, nay chúng ta không có họ ở đây chúng ta cũng cứ gánh vác được như thường[88].
Dù vậy một số thành viên của Việt Quốc, Việt Cách như Chu Bá Phượng, Bồ Xuân Luật vẫn tiếp tục tham gia Chính phủ, kể cả khi lên Việt Bắc. Trương Đình Tri vẫn tiếp tục tham gia chính phủ sau vụ án Ôn Như Hầu[89]. Tại kỳ họp thứ hai Quốc hội, vẫn có 37 đại biểu Việt Quốc, Việt Cách tham gia.
Chính phủ Liên hiệp Quốc dân
Thành lập
Ngày 3 tháng 11 năm 1946 Chính phủ Liên hiệp Quốc dân nhiều thành phần được thành lập thay cho Chính phủ Liên hiệp Kháng chiến nhằm đáp ứng tình hình mới.Hoạt động
Trong thời gian kháng chiến, bộ máy hành chính các cấp có nhiều biến đổi. Tổ chức đơn vị hành chính Khu và Liên khu. Thành lập các Ủy ban kháng chiến các cấp. Cấp Trung ương, thành lập Bộ Tổng chỉ huy quân đội quốc gia (1947), sau đổi là Bộ Tổng tư lệnh (1948) rồi Bộ Quốc phòng Tổng tư lệnh. Các cơ quan tư pháp cơ bản tổ chức theo cấp xét xử.Chính phủ mở rộng từ 1955 đến 1959
Ban đầu, Việt Nam Dân chủ Cộng hòa là chính thể của nước Việt Nam thống nhất, nhưng thực tế sau năm 1954 thì chỉ quản lý từ Vĩnh Linh trở ra. Sau năm 1954 nhà nước bắt đầu đặt ra các mục tiêu cải tạo xã hội chủ nghĩa.Chính phủ từ 1960 đến 1976
Lập pháp
Quốc hội Khóa I
Ngày 20 tháng 9 năm 1945, Ủy ban dự thảo Hiến pháp được thành lập theo Sắc lệnh số 34-SL gồm có 7 thành viên: Hồ Chí Minh, Vĩnh Thụy, Đặng Thai Mai, Vũ Trọng Khánh, Lê Văn Hiến, Nguyễn Lương Bằng, Đặng Xuân Khu (Trường Chinh).Ngày 9 tháng 11 năm 1946, tại kỳ họp thứ hai Quốc hội khóa I đã thông qua Hiến pháp nước Việt Nam Dân chủ Cộng hòa. Dự kiến trưng cầu dân ý toàn quốc thông qua Hiến pháp, bầu cử Nghị viện nhân dân theo quy định của Hiến pháp mới thay cho Quốc hội lập hiến, nhưng chiến tranh nên không thực hiện được. Khi đó Quốc hội chia theo nhóm: Marxist, xã hội chủ nghĩa, dân chủ, Việt Minh, Đồng Minh hội và Việt Nam Quốc dân Đảng,[90], không kể các đại biểu trung lập.
Tiếp đó, Dự án luật Lao động được thông qua và ban hành ngày 8 tháng 11 năm 1946. Đây là dự luật đầu tiên được thông qua.
Ngày 31 tháng 9 năm 1959, trong kỳ họp tại Hà Nội, Quốc hội khóa I thông qua Hiến pháp mới. Do tình hình chiến tranh, Hiến pháp 1946 chưa được chính thức công bố và chưa từng có hiệu lực về phương diện pháp lý.[91]
Quốc hội Khóa II
Quốc hội Khóa III
Quốc hội Khóa IV
Quốc hội Khóa V
Tư pháp
Giai đoạn 1945 - 1954
Giải tán một số đảng phái
Ngay sau khi thành lập để ổn định tình hình, giữ vững nền độc lập non trẻ, ngoài việc giải tán một số đảng phái[33][34] với lý do "tư thông với ngoại quốc", "phương hại đến nền độc lập Việt Nam" (như Việt Nam Quốc xã, Đại Việt Quốc dân đảng...) nhằm kịp thời trừng trị "bọn phản cách mạng", bảo vệ chính quyền non trẻ đồng thời giáo dục ý thức về tinh thần cảnh giác cho nhân dân.[35]; Chính phủ Cách mạng Lâm thời ra các sắc lệnh cho phép Ty Liêm phóng có thể bắt những hạng người bị quy là nguy hiểm cho nền Dân chủ cộng hoà Việt Nam[92].Thành lập Bộ Tư pháp
Bộ Tư pháp Việt Nam được thành lập ngày 28 tháng 8 năm 1945 cùng với Chính phủ Cách mạng lâm thời do luật sư Vũ Trọng Khánh làm Bộ trưởng, sau tháng 3 năm 1946 thì chuyển giao cho luật sư Vũ Đình Hòe. Đến năm 1960, Bộ Tư pháp giải thể.Thành lập Toà án Quân sự
Ngày 13/9/1945, Chủ tịch Chính phủ Cách mạng Lâm thời Việt Nam Dân chủ Cộng hòa ban hành sắc lệnh thành lập các toà án quân sự [93][94][95][96] để xử tất cả các người nào vi phạm vào một việc gì có phương hại đến nền độc lập của nước Việt Nam dân chủ cộng hoà.Theo quy định về thành lập Tòa án Quân sự theo Sắc lệnh 21/SL ngày 14/2/1946 và Sắc lệnh 170/SL của Chủ tịch Chính phủ ngày 14/4/1948. "Toà án quân sự xử tất cả các người nào phạm một việc gì, sau hay trước ngày 19 tháng 8 dương lịch năm 1945, có phương hại đến nền độc lập của nước Việt Nam dân chủ cộng hoà. Trừ những việc nào mà phạm nhân là binh sĩ, dù là tòng phạm hay chính phạm, thì thuộc về nhà binh tự xử lấy." Tòa án quân sự có thể tuyên án: tha bổng, tịch thu một phần hay tất cả tài sản, phạt tù từ 1 đến 10 năm, phạt khổ sai từ 5 đến 10 năm, xử tử. Những quyết nghị của tòa án quân sự sẽ đem thi hành ngay, không có quyền chống án, trừ trường hợp xử tử, tội phạm có quyền đề đơn lên Chủ tịch Chính phủ xin ân giảm. Bản án hoãn thi hành để chờ quyết nghị của Chủ tịch Chính phủ.Thành lập Tòa án Nhân dân Đặc biệt
Sắc lệnh số 150/SL ngày 12/4/1953 thành lập Tòa án nhân dân đặc biệt ở những nơi phát động quần chúng. Mục đích để đảm bảo việc thi hành chính sách ruộng đất, giữ gìn trật tự xã hội, củng cố chính quyền nhân dân, đẩy kháng chiến đến thắng lợi. Nhiệm vụ Tòa án: - Trừng trị những kẻ phản cách mạng, những cường hào gian ác, những kẻ chống lại hoặc phá hoại chính sách ruộng đất; -Xét xử những tranh chấp về tài sản, ruộng đất liên quan đến các vụ án trên; -Xét xử những tranh cãi về phân định thành phần giai cấp.Thẩm quyền Tòa án nhân dân đặc biệt huyện hoặc liên huyện đặt dưới sự lãnh đạo của Ủy ban kháng chiến hành chính tỉnh và đi xử lưu động ở các xã có phát động quần chúng. Việc thành lập Toà án nhân dân đặc biệt ở huyện hay liên huyện do Uỷ ban kháng chiến hành chính tỉnh quyết định và Uỷ ban kháng chiến hành chính liên khu duyệt y. Tòa án nhân dân đặc biệt có Chánh án, 6 đến 10 thẩm phán, đa số là trung nông và bần cố nông, bần cố nông nhiều hơn trung nông. Chánh án và một nửa số thẩm phán do Uỷ ban kháng chiến hành chính tỉnh chọn lựa và Uỷ ban kháng chiến hành chính liên khu duyệt y. Một nửa số thẩm phán do Nông hội hoặc Hội nghị đại biểu nông dân ở huyện hay liên huyện cử ra. Khi đến xã nào xử thì lấy thêm đại biểu nông dân ở xã đó, nhưng số đại biểu lấy vào không được quá 1/3 tổng số thẩm phán. Sắc lệnh số 233/SL ngày 14/6/1955 sửa lại quy định trong Sắc lệnh 150/SL: Khi phân toà đến xã nào xử thì lấy thêm 5 đại biểu nông dân của xã đó. Số đại biểu này do Hội nghị đại biểu nông dân xã bầu ra, và phải là bần cố trung nông; số bần cố nông phải nhiều hơn trung nông. Các đại biểu này có quyền hạn và nhiệm vụ của những thẩm phán.
Tòa án này có quyền tuyên: tha bổng, cảnh cáo, bồi thường, tịch thu tài sản, tước quyền công dân, quản chế địa phương, phạt tù có thời hạn, phạt tù chung thân, xử tử hình. Đối với việc duyệt án, án tù dưới 5 năm do Uỷ ban kháng chiến hành chính tỉnh duyệt và do Chủ tịch Uỷ ban kháng chiến hành chính tỉnh ký vào bản án. án từ 5 năm tù trở lên chung thân và án tử hình thì do Uỷ ban kháng chiến hành chính liên khu duyệt và do Chủ tịch Uỷ ban kháng chiến hành chính liên khu ký vào bản án. Trong 10 ngày sau khi tuyên án, người bị án có quyền chống án.
Giai đoạn 1955 - 1976
Xây dựng hệ thống pháp luật
Sau kháng chiến chống Pháp, Quốc hội khóa I đến khóa V đã thông qua nhiều bộ luật đóng góp vào hệ thống văn bản quy phạm pháp luật của nền Tư pháp Việt Nam Dân chủ Cộng hòa. Ngoài ra Chủ tịch nước Việt Nam Dân chủ Cộng hòa cũng ban hành các sắc lệnh quy định những vấn đề mà Quốc hội chưa ban hành luật.Ngày 14/12/1956, Chủ tịch nước Việt Nam Dân chủ Cộng hòa ra sắc lệnh số 282/SL quy định về chế độ báo chí. Sắc lệnh này quy định tất cả các báo chí đều được hưởng quyền tự do ngôn luận, không phải kiểm duyệt trước khi in (Điều 4). Muốn xuất bản một tờ báo phải xin phép trước, phải làm đầy đủ những thủ tục về khai báo. Sau khi được cơ quan phụ trách về báo chí của Chính phủ cấp giấy phép, tờ báo mới bắt đầu được hoạt động (điều 8).[97]
Ngày 20/5/1957, Chủ tịch nước Việt Nam Dân chủ Cộng hòa ra sắc lệnh số 102/SL-L004 ban hành Luật quy định quyền lập hội. Luật này quy định lập hội phải xin phép và thể lệ lập hội sẽ do Chính phủ quy định (điều 3). Đồng thời những hội đã thành lập trước ngày ban hành Luật quy định quyền lập hội và đã hoạt động trong vùng tạm bị chiếm trong thời kỳ kháng chiến, nay muốn tiếp tục hoạt động, đều phải xin phép lại (điều 4).[98]
Thành lập Viện Công tố Trung ương
Năm 1958, Viện Công tố Trung ương (sau là Viện Kiểm sát Nhân dân Tối cao) được thành lập với Viện trưởng đầu tiên là ông Bùi Lâm.Thành lập Tòa án Nhân dân Tối cao
Tháng 5 năm 1959, Tòa án Nhân dân Tối cao được thành lập với Chánh án Tòa án Nhân dân Tối cao là Luật sư Phạm Văn Bạch.Phân cấp hành chính
Thời kỳ kháng chiến, tổ chức thêm các đơn vị hành chính cấp Khu và Liên khu. Thủ đô kháng chiến đặt ở Việt Bắc.
Theo Hiến pháp năm 1959, Việt Nam Dân chủ Cộng hòa phân cấp hành chính như sau:
| “ |
|
” |
—Điều 78, Hiến pháp Việt Nam Dân Chủ Cộng hòa 1959
|
||
Từ năm 1955, Việt Nam Dân chủ Cộng hòa đã thiết lập Khu tự trị Thái Mèo (sau đổi là Khu tự trị Tây Bắc), gồm ba tỉnh Lai Châu, Sơn La, Nghĩa Lộ, và năm 1956 thiết lập Khu tự trị Việt Bắc gồm 6 tỉnh Cao Bằng, Lạng Sơn, Thái Nguyên, Bắc Cạn, Hà Giang, Tuyên Quang. Khu tự trị là đơn vị hành chính đệm giữa Trung ương và cấp tỉnh. Năm 1975 cấp này bị bãi bỏ.
Chính quyền địa phương
Các tổ chức chính trị
Giai đoạn 1945 -1950 Việt Nam có nhiều đảng phái, tổ chức chính trị thuộc nhiều khuynh hướng chính trị, có ý thức hệ khác nhau[99]. Sau khi Quốc gia Việt Nam thành lập thì Đảng Lao động Việt Nam cũng được thành lập, hoạt động công khai. Đến thời điểm đó và Việt Nam Dân chủ Cộng hòa chỉ còn ba đảng: Đảng Lao động, Đảng Dân chủ và Đảng Xã hội trong Mặt trận Liên Việt. Ba đảng này hoạt động công khai trong vùng do Việt Nam Dân chủ Cộng hòa kiểm soát và ủng hộ Việt Nam Dân chủ Cộng hòa. Tất cả các đảng phái, tổ chức khác đều hoạt động công khai trong vùng do Pháp và Quốc gia Việt Nam kiểm soát và ủng hộ Quốc gia Việt Nam chống Việt Nam Dân chủ Cộng hòa do Đảng Lao động Việt Nam lãnh đạo.Các đảng, tổ chức chống Pháp
- Việt Minh: là tổ chức lớn nhất, không có học thuyết rõ ràng, nhưng theo tài liệu của Mỹ, theo chủ nghĩa dân tộc siêu việt (preeminent nationalist), hợp nhất với Liên Việt từ tháng 3 năm 1949[100]
- Đảng Cộng sản Đông Dương: tuyên bố giải tán 1945 (do Pháp, Mỹ, và Trung Hoa đều chống cộng sản) nhưng theo CIA năm 1931: 1500 thành viên, 1946: 50.000 thành viên, 1950: 400,000 thành viên trong Việt Minh, và là nòng cốt tổ chức này[100]
- Việt Nam Dân chủ Đảng: là tổ chức của giới trung lưu, phần lớn hoạt động ở Bắc kỳ, ủng hộ chính phủ Việt Nam Dân chủ Cộng hòa[100]
- Việt Nam Xã hội Đảng: theo khuynh hướng dân chủ xã hội, ủng hộ chính phủ Việt Nam Dân chủ Cộng hòa[100]
- Việt Nam Quốc dân Đảng: có hệ tư tưởng là chủ nghĩa dân tộc và chủ nghĩa xã hội theo học thuyết Tam dân, một nhóm sau tách ra theo kháng chiến[100]
- Việt Nam Cách mệnh Đồng minh Hội: là một nhóm liên minh năm 1942, sau suy yếu[100]
- Phong trào Trotskyist: chống cả Pháp lẫn Việt Minh, sau suy yếu[100]
Các đảng, tổ chức ủng hộ Bảo Đại
- Mặt trận Thống nhất Quốc gia Liên hiệp: là một liên minh[100]
- Việt Nam Cách mệnh Đồng minh Hội: tái thành lập năm 1946 ở Trung Quốc, có khoảng 5.000 thành viên, định hòa giải với Việt Minh nhưng không thành, ủng hộ Bảo Đại nhưng đòi cứng rắn với Pháp[100]
- Việt Nam Quốc dân đảng (không kể nhóm theo Việt Minh): có khoảng 5.000 thành viên chủ yếu ở miền Bắc, ủng hộ Bảo Đại[100]
- Việt Nam Dân chủ Xã hội Đảng: tách ra từ các nhóm Bình Xuyên, Hòa Hảo, Cao Đài theo Việt Minh ban đầu, ở Nam kỳ, sau đó tháng 11 năm 1947 do tranh chấp với Hòa Hảo, không còn hoạt động[100]
- Đoàn thể Dân chúng: chống Việt Minh, thành lập ở Hà Nội, đến 1949 gần như tan rã[100]
- Việt Nam Quốc gia Thanh niên Đoàn: nhóm nhỏ Bắc kỳ[100]
- Đoàn thể Cao Đài: là tổ chức do Phạm Công Tắc lãnh đạo, bị chia rẽ. Vào tháng Giêng năm 1948, Cao Đài đã ký kết một hiệp ước hòa bình với Phật giáo Hòa Hảo, và cam kết hỗ trợ cho Bảo Đại. Phạm Công Tắc công khai đứng về phía chính phủ Bảo Đại vào tháng Bảy năm 1949.[100]
- Phật giáo Hòa Hảo: chống Anh -Pháp giai đoạn 1945 thời Huỳnh Phú Sổ, sau ủng hộ cho phục hồi Bảo Đại, nhưng quan hệ với các phe phái khác và Pháp còn căng thẳng.[100]
- Tịnh độ cư sĩ: chủ yếu người gốc Hoa.[100]
- Việt Nam Liên đoàn Công giáo: ban đầu ủng hộ Việt Nam Dân chủ Cộng hòa, sau được Ngô Đình Diệm đưa vào Mặt trận Thống nhất Quốc gia Liên hiệp ủng hộ Bảo Đại.[100]
- Liên khu Bình Xuyên: ban đầu hợp tác với Việt Minh, sau một nhóm tách ra hợp tác với Bảo Đại, nhưng cảnh giác với Pháp
- Việt Nam Quốc gia Liên hiệp: thành lập tháng 12 năm 1947, tại Hà Nội vận động chính trị ủng hộ Bảo Đại, nhưng hoạt động ít hiệu quả.[100]
- Việt Nam Phục quốc Đồng minh Hội: phục hồi từ 1947 từ các phần tử dân tộc chủ nghĩa theo gương Nhật Bản, hoạt động ít hiệu quả, trong năm 1946 và 1947 Cường Để vận động Mỹ chống Pháp, Hồ Chí Minh và Bảo Đại hòa giải, nhưng Cường Để chết 1951, tổ chức tan vỡ.[100]
- Các tổ chức thuận Pháp: Đảng Dân chủ Đông Dương, Đảng Dân chủ Nam Kỳ, Mặt trận Nhân dân Đông Dương, và Phong trào Nhân dân Nam Kỳ, ủng hộ cho giải pháp của Pháp, ít nhiều hỗ trợ cho Bảo Đại.[100]
Kinh tế
Cải cách ruộng đất
Trong 3.563 xã thuộc 22 tỉnh và những vùng ngoại thành ở miền Bắc đã thực hiện cải cách ruộng đất, các đội cải cách ruộng đất đã chỉ ra 47.890 địa chủ, chiếm 1,87% tổng số hộ và 2,25% tổng số nhân khẩu ở nông thôn. Trong số địa chủ đó, có 6.220 hộ là cường hào gian ác, chiếm 13% tổng số hộ địa chủ. Nghị quyết của Hội nghị Trung ương Đảng Lao động Việt Nam lần thứ 14 về tổng kết cải cách ruộng đất đã nêu rõ: "Những tên địa chủ có nhiều tội ác với nông dân và là phản động đầu sỏ cùng một số tổ chức của chúng đã bị quần chúng tố cáo và bị trừng trị theo pháp luật". Số địa chủ bị tuyên án tử hình trong chương trình Cải cách ruộng đất không được thống kê chính xác và gây tranh cãi. Các nhà nghiên cứu phương Tây đưa ra các số liệu rất khác nhau và không thống nhất, theo Gareth Porter: từ 800 đến 2.500 người bị tử hình;[101] theo Edwin E. Moise (sau một công cuộc nghiên cứu sâu rộng hơn): vào khoảng 5.000; theo giáo sư sử học James P. Harrison: vào khoảng 1.500 người bị tử hình cộng với 1.500 bị giam giữ.[102]. Do tiến hành vội vã, nhiều địa chủ bị kết án oan sai, nên từ năm 1956, các chiến dịch sửa sai được tiến hành, các địa chủ bị kết án oan được trả tự do, minh oan, trả lại danh dự và được tạo điều kiện sinh sống[103]. Qua cải cách ruộng đất ở miền Bắc, trên 810.000 hecta ruộng đất của đế quốc và địa chủ, ruộng đất tôn giáo, ruộng đất công và nửa công nửa tư đã bị tịch thu, trưng thu, trưng mua để chia cho 2.220.000 hộ nông dân lao động và dân nghèo ở nông thôn, bao gồm trên 9.000.000 nhân khẩu. Như vậy là 72,8% số hộ ở nông thôn miền Bắc đã được chia ruộng đất. Tính đến tháng 4 năm 1953, số ruộng đất trực tiếp tịch thu của địa chủ chia cho nông dân bằng 67,67% tổng số ruộng đất mà địa chủ chiếm hữu nǎm 1945.[104]
Cải tạo kinh tế
Kế hoạch 5 năm lần thứ nhất (1961-1965)
Giai đoạn 1966-1976
Ngoại giao
Việt Nam Dân chủ Cộng hòa được Pháp công nhận là một nước tự do thuộc Liên hiệp Pháp tại Hiệp định sơ bộ năm 1946. Sau đó, được các nước trong phe xã hội chủ nghĩa cũng như các nước khác công nhận sau này, khởi đầu bởi Trung Quốc và Liên Xô vào năm 1950. Tiếp theo là các nước Ba Lan, Tiệp Khắc, Đông Đức, Hungary, Bungary, Triều Tiên, Albania, Romania. Năm 1954, Cộng hòa Nhân dân Mông Cổ mới đặt quan hệ ngoại giao với Việt Nam. Cùng năm, khi tiếp quản Hà Nội, Chủ tịch Hồ Chí Minh ra lệnh công nhận cơ quan ngoại giao của Ấn Độ tại Hà Nội. Ngày 17 tháng 10 năm 1954, Thủ tướng Ấn Độ Jawaharlal Nehru sang thăm Việt Nam.[109]Các nước Tây phương thì mãi đến năm 1967, Pháp mới lập phòng liên lạc và đại diện bán chính thức rồi đến Thụy Sĩ năm 1968. Tuy nhiên đây là chỉ cấp bán chính thức, không có đại sứ. Năm 1969 Thụy Điển là quốc gia Tây Âu đầu tiên thiết lập ngoại giao toàn phần với Miền Bắc kể cả trao đổi đại sứ. Theo sau đó là Senegal (1969), Ceylon (1970), Thụy Sĩ (1971), Ấn Độ (1972), Chile, và Pakistan. Tính đến hết tháng 12 năm 1972, có 49 quốc gia bang giao với nước Việt Nam Dân chủ Cộng hòa.[110]
Năm 1975 Việt Nam Dân chủ Cộng hòa cùng Cộng hòa Miền Nam Việt Nam đứng hai đơn gia nhập Liên hiệp quốc nhưng bị Hoa Kỳ phủ quyết cả hai.[111] Tuy nhiên cũng năm này Việt Nam Dân chủ Cộng hòa được gia nhập hai cơ quan quốc tế là WMO (World Meteorological Organization, Tổ chứ Khí tượng Thế giới) ngày 7 tháng 8, 1975 và WHO (World Health Organization, Tổ chức Y tế Thế giới) ngày 22 tháng 10, 1975. Đây là hai tổ chức quốc tế đầu tiên (không kể những tổ chức riêng của khối xã hội chủ nghĩa) quốc gia này tham gia.[110]
Quân đội
Ở miền Nam, Vệ quốc đoàn có nhiều đơn vị của các giáo phái Cao Đài, Hòa Hảo, Bình Xuyên tuy chấp hành những chỉ thị quân sự của cấp trên nhưng lại từ chối tiếp nhận các chính ủy do cấp trên cử xuống. Sau những xung đột quân sự giữa các đơn vị do giáo phái chỉ huy với những đơn vị do Việt Minh chỉ huy, và nhất là sau khi giáo chủ Huỳnh Phú Sổ của Hòa Hảo mất tích (Hòa Hảo cho là do Việt Minh thủ tiêu), lực lượng quân sự của các giáo phái Cao Đài, Hòa Hảo, Bình Xuyên ly khai khỏi Vệ quốc đoàn hợp tác với chính phủ Cộng hòa tự trị Nam Kỳ và sau này với Quốc gia Việt Nam.[cần dẫn nguồn]
Năm 1950, Quân đội Quốc gia Việt Nam đổi tên thành Quân đội Nhân dân Việt Nam. Sau 1954, quân đội Việt Nam Dân chủ Cộng hòa vẫn giữ tên gọi Quân đội Nhân dân Việt Nam.
Văn hóa, xã hội
Giáo dục
Lãnh đạo qua các thời kỳ
Nguồn tham khảo
- ^ Hiến pháp năm 1946 của Việt Nam Dân chủ Cộng hòa
- ^ Hiến pháp năm 1959 của Việt Nam Dân chủ Cộng hòa
- ^ The Pentagon Papers (1971), Beacon Press, vol. 3, p. 134.
- ^ The Pentagon Papers (1971), Beacon Press, vol. 3, p. 119.
- ^ The Pentagon Papers (1971), Beacon Press, vol. 3, p. 140.
- ^ Lệnh khởi nghĩa (*) (Quân lệnh số 1 của ủy ban khởi nghĩa), Báo Nhân dân, 12/08/2010
- ^ a b Giai đoạn 1945-1954: Kháng chiến và Kiến quốc, I - TỪ ỦY BAN DÂN TỘC GIẢI PHÓNG ĐẾN CHÍNH PHỦ LÂM THỜI NƯỚC VIỆT NAM DÂN CHỦ CỘNG HÒA, CỔNG THÔNG TIN ĐIỆN TỬ CHÍNH PHỦ
- ^ Sự kiện ngày 14-8-1945 là mốc son rực rỡ, TÙNG LINH, 14/08/2007, Báo điện tử Khánh Hòa
- ^ Thái Bình tổng khởi nghĩa giành chính quyền tháng 8 năm 1945, Cổng thông tin điện tử Tỉnh Thái Bình
- ^ Quảng Trị trong những ngày mùa thu năm 1945, BÁO QUẢNG TRỊ ĐIỆN TỬ, 19/08/2013
- ^ Hà Nội, ngày 19-8-1945, trích hồi ký của Lê Trọng Nghĩa, Tạp chí Hướng nghiệp & Hoà nhập
- ^ Năm 1945, Thanh niên Tiền phong là thành viên của Mặt trận Việt Minh, 09/08/2013, Bùi Hiển, Ủy ban mặt trận tổ quốc Việt Nam TP.HCM
- ^ Bảo Đại, Con Rồng Việt Nam, Nguyễn Phước Tộc Xuất Bản, 1990, trang 186-188
- ^ Tản mạn nhân vật lịch sử Trần Trọng Kim qua những trang hồi ký (Kỳ II): Chính khách bất đắc dĩ?, Trần Văn Chánh, Tạp chí Nghiên cứu và Phát triển, số 6-7 (104-105), 2013
- ^ Stéphane Just: A propos d'une possibilité théorique et de la lutte pour la dictature du prolétariat trên La Vérité" n°588 (Septembre 1979)
- ^ Paul-Marie de La GORCE:De Gaulle-Leclerc: de Londres à l'Indochine Espoir n°132, 2002
- ^ Ba quyết định lịch sử của Chủ tịch Hồ Chí Minh!, Trần Thanh Mai, Tạp chí của Ban Tuyên giáo Trung ương, số ra ngày 18/12/2010, Trích: "Tuy nhiên, khi biết tin Hiệp định sơ bộ được ký kết, dư luận các đảng phái quốc gia và thân nước ngoài như Việt Cách, Việt Quốc đã lên tiếng phản đối, nhân dân cũng còn chỗ băn khoăn, thì Chủ tịch Hồ Chí Minh đã bình tĩnh giải thích và động viên đồng bào rằng: cần phải biết chịu đựng hy sinh để mưu sự nghiệp lớn. Đành phải hy sinh không gian để tranh thủ thời gian…và nhất là “phải biết giành thắng lợi từng phần”."
- ^ United States – Vietnam Relations, 1945–1967: A Study Prepared by the Department of Defense/I. B
- ^ CÙNG TRUNG ƯƠNG ĐẢNG VÀ CHÍNH PHỦ LÃNH ĐẠO CUỘC KHÁNG CHIẾN CHỐNG THỰC DÂN PHÁP (1945 - 1954)
- ^ a b Tønnesson, Stein. Vietnam 1946: How the War Began. Berkeley, CA: California University Press, 2010. tr 83-85
- ^ Lê Đình Chi. Người Thượng Miền Nam Việt Nam. Gardena, CA: Văn Mới, 2006. tr 569-612
- ^ Duncanson, Dennis. Government and Revolution in Vietnam. New York: Oxford University Press, 1968. tr 165
- ^ Pierre Quatrpoint. Sự mù quáng của tướng De Gaulle đối với cuộc chiến ở Đông Dương. NXB Chính trị quốc gia. Hà Nội. 2008. trang 77 (bản tiếng Việt do Đặng Văn Việt dịch)
- ^ Ban nghiên cứu lịch sử Đảng. Văn kiện Đảng (1945-1954). NXB Sự thật. Hà Nội. 1978, trang 256-260
- ^ Hồ Chí Minh. Toàn tập - Tập 4. NXB Chính trị quốc gia. Hà Nội. 2000. trang 328-330
- ^ Có thể xem nội dung bức thư (bằng tiếng Anh) tại [1]. Bức thư này không được trả lời cũng như không được công bố trước công chúng tới tận năm 1972
- ^ Barnet, Richard J. (1968). Intervention and Revolution: The United States in the Third World. World Publishing. tr. 185. ISBN 0-529-02014-9.
- ^ Prados, John (August 2007, Volume 20, Number 1). The Smaller Dragon Strikes. MHQ: The Quarterly Journal of Military History. tr. 50. ISSN 1040-5992.
- ^ Paul-Marie de La GORCE:De Gaulle-Leclerc: de Londres à l'Indochine Espoir n°132, 2002.
- ^ Xem thêm bài Đường Trường Sơn để biết thêm về tuyến đường chiến lược viện trợ cho miền Nam.
- ^ a b c Chiến khu Trần Hưng Đạo, Chương 3 - Chiến khu Trần Hưng Đạo trong tổng khởi nghĩa tháng 8 và những tháng đầu bảo vệ chính quyền cách mạng (8/1945-10/1945),trang 106,114,115,118 - 123, Bộ tư lệnh quân khu 3, Nxb Quân đội nhân dân, 1993
- ^ Tuyên cáo của Chính phủ lâm thời Việt Nam Dân chủ cộng hoà, Cổng thông tin điện tử Bộ Tư pháp Việt Nam
- ^ a b SẮC LỆNH CỦA CHỦ TỊCH CHÍNH PHỦ LÂM THỜI SỐ 8 NGÀY 5 THÁNG 9 NĂM 1945
- ^ a b SẮC LỆNH CỦA CHỦ TỊCH CHÍNH PHỦ LÂM THỜI SỐ 30 NGÀY 12 THÁNG 9 NĂM 1945
- ^ a b Nhớ mãi về bác Bùi Lâm, Tạp chí Kiểm sát
- ^ SẮC LỆNH CỦA CHỦ TỊCH CHÍNH PHỦ LÂM THỜI SỐ 36 NGÀY 22 THÁNG 9 NĂM 1945
- ^ Bộ Giáo dục và Đào tạo, Phan Ngọc Liên (Tổng chủ biên), Lịch sử 12 nâng cao, NXB Giáo dục, Thanh Hóa, 2008. Trang 169.
- ^ a b Võ Nguyên Giáp, Những năm tháng không thể nào quên, NXB Trẻ, 2009. Trang 33, 34, 35, 36.
- ^ a b c Chống giặc đói, GS ĐẶNG PHONG, Báo Tuổi Trẻ, 07/03/2005
- ^ Chủ tịch Hồ Chí Minh với phong trào Bình dân học vụ, Phạm Hải Yến, Trung tâm Lưu trữ Quốc Gia III
- ^ TUẦN LỄ VÀNG 1945 - MỘT KỲ TÍCH CỦA CÁCH MẠNG 60 NĂM VỀ TRƯỚC
- ^ Tuần lễ Vàng - sức mạnh lòng dân
- ^ Năm 1945 - Chính phủ lâm thời đề ra những biện pháp giải quyết khó khăn về tài chính
- ^ Why Vietnam, Archimedes L.A Patti, Nxb Đà Nẵng, 2008, trang 551 - 552
- ^ a b c Lê Mậu Hãn (chủ biển), Trần Bá Đệ, Nguyễn Văn Thư, Đại cương lịch sử Việt Nam - Tập 3, NXB Giáo dục, 2007. Trang 10.
- ^ Việt Nam Quốc dân Đảng trong thời kỳ thoái trào và biến chất (1930-1954), Nguyễn Văn Khánh, Tạp chí nghiên cứu lịch sử số 6/410(2010), Viện sử học Việt Nam
- ^ Võ Nguyên Giáp, Những năm tháng không thể nào quên, NXB Trẻ, 2009. Trang 35
- ^ Đại tướng Võ Nguyên Giáp, Tổng tập Hồi ký, Những năm tháng không thể nào quên, NXB QĐND, trang 158, 159.
- ^ Một Cơn Gió Bụi, Chương 6: Chính phủ Việt Nam và tình thế trong nước, Trần Trọng Kim, Tạp chí Văn hóa Nghệ An
- ^ Một Cơn Gió Bụi, Chương 9: Đi sang Tàu, Trần Trọng Kim, Tạp chí Văn hóa Nghệ An
- ^ Why Vietnam, Archimedes L.A Patti, Nxb Đà Nẵng, 2008, trang 537, 543
- ^ Cecil B. Currey. Chiến thắng bằng mọi giá. NXB Thế giới. Trang 174
- ^ Why Vietnam, Archimedes L.A Patti, Nxb Đà Nẵng, 2008, trang 548, 549, 554
- ^ Why Vietnam, Archimedes L.A Patti, Nxb Đà Nẵng, 2008, trang 563 - 564
- ^ Why Vietnam, Archimedes L.A Patti, Nxb Đà Nẵng, 2008, trang 78
- ^ Why Vietnam, Archimedes L.A Patti, Nxb Đà Nẵng, 2008, trang 549
- ^ Why Vietnam, Archimedes L.A Patti, Nxb Đà Nẵng, 2008, trang 544 - 545
- ^ Why Vietnam, Archimedes L.A Patti, Nxb Đà Nẵng, 2008, trang 543
- ^ Theo bài "Tai bay vạ gió" trong ngoại giao? Những nỗi truân chuyên của Việt Nam trên con đường hội nhập Phong trào Quốc tế Cộng sản (1945–1950), Christopher Goscha của Đại học Québec tại Montréal, đăng tại tạp chí Journal of Vietnamese Studies[liên kết hỏng] thì khi gặp nhau ở Trung Quốc năm 1950, Lưu Thiếu Kì đã nói với ông rằng Đảng Cộng sản Trung Quốc đã nhận xét hành động này của Việt Nam như sự "xa rời lý tưởng cộng sản".
- ^ Why Vietnam, Archimedes L.A Patti, Nxb Đà Nẵng, 2008, trang 591 - 592
- ^ Võ Nguyên Giáp, Những năm tháng không thể nào quên, NXB Trẻ, 2009. Trang 108.
- ^ Lê Mậu Hãn (chủ biển), Trần Bá Đệ, Nguyễn Văn Thư, Đại cương lịch sử Việt Nam - Tập 3, NXB Giáo dục, 2007. Trang 17.
- ^ Cecil B. Currey. Chiến thắng bằng mọi giá. trang 177, NXB Thế giới, 2013
- ^ Võ Nguyên Giáp, Những năm tháng không thể nào quên, NXB Trẻ, 2009. Trang 33.
- ^ Võ Nguyên Giáp, Những năm tháng không thể nào quên, NXB Trẻ, 2009. Trang 113.
- ^ Mãi mãi ghi nhớ Quốc hội khoá I (17/05/2011), Thái Duy, Báo Đại Đoàn Kết, số ra ngày 17/05/2011, trích "Bọn phản động tưởng trúng cử chỉ là Việt Minh cộng sản, chúng cho là chính quyền trong tay nên Việt Minh muốn ai trúng cũng được."
- ^ a b c Mãi mãi ghi nhớ Quốc hội khoá I (17/05/2011), Thái Duy, Báo Đại Đoàn Kết, số ra ngày 17/05/2011
- ^ Nohlen, D, Grotz, F & Hartmann, C (2001) Elections in Asia: A data handbook, Volume II, p. 324 ISBN 0-19-924959-8
- ^ Cựu Thủ tướng chính quyền được bảo quân đội Nhật Bản bảo hộ.
- ^ Một cơn gió bụi, Chương VI: Chính phủ Việt Nam và tình thế trong nước
- ^ Võ Nguyên Giáp, Những năm tháng không thể nào quên, NXB Trẻ, 2009. Trang 99.
- ^ Đại tướng Võ Nguyên Giáp - Tổng tập Hồi ký, Những năm tháng không thể nào quên, trang 315
- ^ Cecil B. Currey. CHiến thắng bằng mọi giá. NXB Thế giới. Trang 177 -178
- ^ Bác Hồ - hồi kí, NXB Văn học, trang 112, phần kể của Nguyễn Lương Bằng.
- ^ a b Chiến thắng bằng mọi giá, trang 196-197, Cecil B. Currey, Nxb Thế Giới, 2013
- ^ a b Đại tướng Võ Nguyên Giáp - Tổng tập Hồi ký, Những năm tháng không thể nào quên, trang 290
- ^ Đại tướng Võ Nguyên Giáp, Tổng tập Hồi Ký, Những năm tháng không thể nào quên, trang 274
- ^ Việt Nam, một thế kỷ qua, Nguyễn Tường Bách, Nxb Thạch Ngữ, California, 1998
- ^ Bộ trưởng Nguyễn Tường Tam, Trang web Bộ Ngoại giao
- ^ Võ Nguyên Giáp, Những năm tháng không thể nào quên, NXB Trẻ, 2009. Trang 288-289
- ^ a b Phạm Văn Quyền (chủ biên). 60 năm Công an nhân dân Việt Nam. NXB Công an nhân dân. 2006. trang 104.
- ^ Nguyễn Trọng Khuê (chủ biên). Những trang sử vẻ vang của Công an nhân dân Việt Nam (1945-2005). NXB Công an nhân dân. Hà Nội. 2005. trang 14-16
- ^ Vụ án Ôn Như Hầu qua lời kể của Đại tá Trần Tấn Nghĩa, Báo Công an Nhân dân Điện tử, 8:40, 28/08/2005, Trích: "Theo ông kể, cuối tháng 6/1946, Nha Công an Trung ương nhận được nguồn tin của cơ sở phát hiện được âm mưu của thực dân Pháp câu kết với bọn phản động Quốc dân Đảng đang chuẩn bị thực hiện âm mưu đảo chính chính phủ của Chủ tịch Hồ Chí Minh. Sau khi xin ý kiến trung ương về âm mưu thâm độc này, đồng chí Trường Chinh, Tổng Bí Thư đảng ta lúc bấy giờ đã cho ý kiến chỉ đạo phải tập trung trấn áp bọn phản cách mạng, nhưng phải có đủ chứng cứ."
- ^ a b Con trai “ông tiên thuốc nam” phá vụ án Ôn Như Hầu, Thanh Sơn – Kiến Quốc, Pháp lý online, 3/3/2011
- ^ a b Vụ án phố Ôn Như Hầu, thiếu tướng Lê Hữu Qua, Báo Nhân Dân, ngày 19/8/2005
- ^ Đại tướng Võ Nguyên Giáp - Tổng tập Hồi ký, Những năm tháng không thể nào quên, trang 292
- ^ HIẾN PHÁP NƯỚC Việt Nam DÂN CHỦ CỘNG HOÀ (QUỐC HỘI NƯỚC Việt Nam DÂN CHỦ CỘNG HOÀ THÔNG QUA NGÀY 9-11-1946), CHƯƠNG IV, CHÍNH PHỦ
- ^ Hồ Chủ tịch trả lời chất vấn qua lời kể Tướng Giáp
- ^ Chủ tịch Hồ Chí Minh trả lời chất vấn Quốc hội
- ^ Stein Tennesson:Vietnam 1946: How the War Began, University of California Press, tr.91
- ^ Phạm Duy Nghĩa, Bản Hiến pháp sáu mươi năm trước và những món nợ lịch sử
- ^ SẮC LỆNH CỦA CHỦ TỊCH CHÍNH PHỦ LÂM THỜI SỐ 33A NGÀY 13 THÁNG 9 NĂM 1945
- ^ SẮC LỆNH CỦA CHỦ TỊCH CHÍNH PHỦ LÂM THỜI SỐ 33C NGÀY 13 THÁNG 9 NĂM 1945
- ^ SẮC LỆNH CỦA CHỦ TỊCH CHÍNH PHỦ LÂM THỜI SỐ 37 NGÀY 26 THÁNG 9 NĂM 1945
- ^ SẮC LỆNH CỦA CHỦ TỊCH CHÍNH PHỦ LÂM THỜI SỐ 40 NGÀY 29 THÁNG 9 NĂM 1945
- ^ SẮC LỆNH CỦA CHỦ TỊCH CHÍNH PHỦ LÂM THỜI SỐ 77-C NGÀY 28 THÁNG 12 NĂM 1945
- ^ Sắc lệnh số 282/SL ngày 14 tháng 12 năm 1956, CHỦ TỊCH NƯỚC Việt Nam DÂN CHỦ CỘNG HOÀ
- ^ SẮC LỆNH SỐ 102/SL-L004 NGÀY 20-5-1957 QUY ĐỊNH QUYỀN LẬP HỘI, Quốc hội Việt Nam
- ^ United States – Vietnam Relations, 1945–1967: A Study Prepared by the Department of Defense/I. B. The Character and Power of the Viet Minh
- ^ a b c d e f g h i j k l m n o p q r s t United States – Vietnam Relations, 1945–1967: A Study Prepared by the Department of Defense/I. B. The Character and Power of the Viet Minh
- ^ Gavin W. Jones, "Population Trends and Policies in Vietnam: Population and Development Review", Vol. 8, No. 4 (Dec., 1982), pp. 783-810
- ^ The Endless War: Vietnam Struggle For Independence, Columbia University Press, 1989, trang 149
- ^ KẾ HOẠCH TIẾN HÀNH SỬA CHỮA SAI LẦM VỀ CẢI CÁCH RUỘNG ĐẤT NHIỆM VỤ CHUNG, KEHOACH-TTg, Phạm Văn Đồng, Hà Nội, ngày 20 tháng 12 năm 1956
- ^ Nghị quyết của Hội nghị Trung ương lần thứ 14 về tổng kết cải cách ruộng đất, Văn kiện hội nghị, Báo điện tử Đảng Cộng sản Việt Nam
- ^ Lê Mậu Hãn (chủ biên), Trần Bá Đệ, Nguyễn Văn Thư,..., Đại cương Lịch sử Việt Nam tập 3, NXB Giáo dục, 2007. Trang 147, 148.
- ^ Báo cáo về nhiệm vụ kế hoạch ba năm (1958-1960) phát triển và cải tạo kinh tế quốc dân, Văn kiện Đảng, Báo điện tử Đảng Cộng sản Việt Nam
- ^ NGHỊ QUYẾT VỀ TÌNH HÌNH, NHIỆM VỤ VÀ KẾ HOẠCH 3 NĂM (1958 - 1960) PHÁT TRIỂN VÀ CẢI TẠO KINH TẾ, PHÁT TRIỂN VĂN HOÁ, QUỐC HỘI NƯỚC VIỆT NAM DÂN CHỦ CỘNG HOÀ HỌP KHOÁ THỨ IX, CỔNG THÔNG TIN ĐIỆN TỬ BỘ TƯ PHÁP
- ^ Giai đoạn 1955-1975: Xây dựng CNXH và Đấu tranh thống nhất đất nước, Phần 2: Hoàn thành Cải tạo xã hội chủ nghĩa, bước đầu phát triển kinh tế và văn hóa - đưa miền Bắc vào thời kỳ quá độ lên chủ nghĩa xã hội, Cổng Thông tin điện tử Chính phủ
- ^ Viện Sử học, Việt Nam những sự kiện lịch sử (1945-1975), NXB Giáo dục, 2006. Trang 145.
- ^ a b Bühler, Konrad G. State succession and membership in international organizations. The Hague: Kluwer Law International, 2001. tr 68-92
- ^ Odd Arne Westad, Sophie Quinn-Judge. The Third Indochina War: conflict between China, Vietnam and Cambodia, 1972-79. Abingdon, UK: Routledge, 2006. tr 69
Xem thêm
- Chính phủ Cách mạng lâm thời Việt Nam Dân chủ Cộng hòa
- Chính phủ Liên hiệp Lâm thời Việt Nam Dân chủ Cộng hòa
- Chính phủ Liên hiệp Kháng chiến Việt Nam Dân chủ Cộng hòa
- Chính phủ Liên hiệp Quốc dân
Liên kết ngoài
| Wikisource tiếng Việt có toàn văn tác phẩm về:
|
| Wikisource tiếng Việt có toàn văn tác phẩm về:
|
| Tiền nhiệm: Nhà Nguyễn Đế quốc Việt Nam |
Việt Nam Dân chủ Cộng hòa 1945–1954 |
Kế nhiệm: CHXHCN Việt Nam |
| Việt Nam Dân chủ Cộng hòa (Vĩ tuyến 17 Bắc) 1954–1976 |
Thể loại:
Ghana (Tiếng Việt: Ga-na[1]), tên chính thức là Cộng hòa Ghana (Republic of Ghana) là một quốc gia tại Tây Phi. Ghana có biên giới với Côte d'Ivoire về phía tây, Burkina Faso về phía bắc, Togo về phía đông, còn về phía nam là Vịnh Guinea. Thủ đô và cũng là thành phố lớn nhất của Ghana là Accra.
Người dân Ghana cho rằng lịch sử của họ bắt nguồn từ Vương quốc Ghana cổ xưa tồn tại từ thế kỉ 8 đến thế kỉ 13 tại phía tây châu Phi, nhưng đến khi vương quốc này sụp đổ thì cư dân của nó đã di cư xuống phía nam và lập nên những tiểu quốc Fante và đặc biệt là Vương quốc Ashante hùng mạnh. Những mối liên hệ về thương mại với người Bồ Đào Nha được thiết lập từ thế kỉ 15 và đến năm 1874, Ghana trở thành một thuộc địa của Liên Hiệp Anh với tên gọi Bờ Biển Vàng (Gold Coast). Năm 1957, Ghana trở thành thuộc địa đầu tiên ở vùng Châu Phi hạ Sahara giành được độc lập.
Bờ Biển Vàng giành độc lập từ tay Vương quốc Anh vào năm 1957 và trở thành quốc gia độc lập đầu tiên ở khu vực hạ Sahara.[2][3][4] Ghana được chọn làm tên mới cho quốc gia này để ghi nhớ Đế chế Ghana, đã từng trải dài khắp cả khu vực Tây Phi. Ghana là thành viên của Khu vực hòa bình và hợp tác Nam Đại Tây Dương, Khối thịnh vượng chung, Cộng đồng Kinh tế Tây Phi, Liên minh châu Phi và là thành viên liên kết của Cộng đồng Pháp ngữ. Ghana là nước có sản lượng cacao đứng thứ 2 thế giới. Hồ nhân tạo lớn nhất thế giới về diện tích bề mặt Volta nằm ở quốc gia này.[5]
Từ năm 1471, người Bồ Đào Nha thám hiểm và khám phá ra vùng bờ biển mà sau này có tên gọi là Gold Coast (Côte de l'Or, Bờ biển Vàng). Họ xây dựng pháo đài Elmina và giữ độc quyền buôn bán vàng trong khoảng một thế kỉ rưỡi. Sau khi loại trừ người Bồ Đào Nha, người Hà Lan, người Anh và một số thương gia châu Âu phân chia quyền kiểm soát và biến vùng này thành trung tâm mua bán nô lệ.
Từ năm 1826, người Anh thực hiện một loạt các chiến dịch chống lại người bản xứ Ashanti ở sâu bên trong nội địa. Vùng duyên hải trở thành thuộc địa Anh (1874). Năm 1901, người Ashanti đầu hàng người Anh và lãnh thổ phía bắc trở thành xứ bảo hộ. Vùng Togoland lân cận, thuộc địa cũ của Đức, thuộc quyền ủy trị của Anh từ năm 1922.
Năm 1957, Gold Coast là thuộc địa đầu tiên ở châu Phi giành được độc lập và đổi tên thành Ghana. Nền cộng hòa ra đời sau khi hiến pháp được thông qua (năm 1960). Chủ nghĩa chuyên quyền của Tổng thống Kwame Nkrumah và sự suy thoái kinh tế trong nước dẫn đến cuộc đảo chính quân sự năm 1966.
Từ đó, đất nước rơi vào tình trạng bất ổn chính trị cho đến khi Jerry J. Rawlings lên nắm quyền năm 1981. Rawlings tiến hành khôi phục kinh tế và dân chủ. Được bầu làm Tổng thống năm 1992, Rawlings công bố hiến pháp mới và chấm dứt chế độ quân sự. Ứng cử viên đối lập John Kufuor lên cầm quyền sau khi giành thắng lợi trong cuộc tuyển cử Tổng thống năm 2000.
 Theo Bảng xếp hạng Chỉ số thất bại của nhà nước năm 2009, Ghana đứng ở vị trí thứ 124 trên thế giới và đứng áp chót trong số các nước châu Phi, trước Mauritius, dựa theo các số liệu từ năm 2006.[6]
Ghana cũng xếp thứ 7 trong số 48 nước vùng hạ Sahara vào năm 2008 theo
chỉ số Ibrahim, phản ánh sự thành công của các chính sách chính phủ đối
với dân chúng.[7]
Theo Bảng xếp hạng Chỉ số thất bại của nhà nước năm 2009, Ghana đứng ở vị trí thứ 124 trên thế giới và đứng áp chót trong số các nước châu Phi, trước Mauritius, dựa theo các số liệu từ năm 2006.[6]
Ghana cũng xếp thứ 7 trong số 48 nước vùng hạ Sahara vào năm 2008 theo
chỉ số Ibrahim, phản ánh sự thành công của các chính sách chính phủ đối
với dân chúng.[7]
Ghana thực hiện đường lối đối ngoại đa dạng hoá, đa phương hoá, coi trọng quan hệ với Mỹ, Tây Âu, Nhật Bản để tranh thủ vốn, kỹ thuật. Ghana nhận được sự trợ giúp của Mỹ trong khuôn khổ chương trình “đào tạo các chuyên gia quân sự nước ngoài” (IMET), chương trình “trợ giúp trong việc huấn luyện tiến hành các hoạt động chống khủng bố tại châu Phi” (ACOTA).
Nhiều chính trị gia và nhà ngoại giao Ghana đang làm việc tại các tổ chức quốc tế, trong số đó phải kể đến cựu Tổng thư ký Liên hợp quốc Kofi Annan, thẩm phán Tòa án hình sự quốc tế Akua Kuenyehia và cựu tổng thống Jerry Rawlings, đang là chủ tịch của Cộng đồng kinh tế Tây Phi.[8]
Ghana hiện là thành viên tích cực của nhiều tổ chức khu vực và quốc tế như: WTO, Phong trào không liên kết (NAM), Liên minh châu Phi (AU), Cộng đồng Kinh tế Tây Phi (ECOWAS).
 Đập thủy điện Akosombo được xây dựng vào năm 1965 trên sông Volta cung cấp điện năng cho cả Ghana và các nước láng giềng.
Đập thủy điện Akosombo được xây dựng vào năm 1965 trên sông Volta cung cấp điện năng cho cả Ghana và các nước láng giềng.
Năm 2008, lực lượng lao động của Ghana có khoảng 11,5 triệu người.[15] Kinh tế của Ghana chủ yếu vẫn dựa vào nông nghiệp, chiếm tới 37,3% GDP và cung cấp việc làm cho 56% số người lao động,[15] phần lớn trong số đó là những người sản xuất nhỏ. Tỉ trọng công nghiệp của Ghana vào năm 2007 chiếm 7,9% GDP.[16]
Những chính sách không mấy hiệu quả của chính quyền quân sự cũ và các cam kết giữ gìn hòa bình khu vực đã dẫn đến tình trạng lạm phát thâm hụt tài chính, sự sụt giá của đồng Cedi cũng như sự không hài lòng của công chúng với những biện pháp kém cỏi của chính phủ Ghana. Mặc dầu vậy, Ghana vẫn là một trong những quốc gia ổn định về kinh tế nhất châu lục Đen.
Tháng 7 năm 2007, Ngân hàng nhà nước Ghana quyết định thay đổi đồng tiền đang sử dụng Cedi (¢) sang đồng Ghana Cedi (GH¢) để tái kiểm soát tiền tệ trong nước. Tỉ giá của thu đổi là 1 Ghana Cedi cho 10,000 Cedi (cũ). Ngân hàng nhà nước Ghana đã tiến hành các chiến dịch truyền thông mạnh mẽ nhằm thông báo cho người dân Ghana về chính sách này.
Đồng tiền mới, Ghana Cedi, đã dần đi vào ổn định và đến năm 2009 trung bình $1 USD =Gh¢ 1.4 [15]. Thuế giá trị gia tăng (VAT) cũng được áp dụng ở Ghana bắt đầu từ năm 1989 với một mức tỉ lệ áp dụng chung cho tất cả (các loại hàng hóa hoặc cá nhân). Bắt đầu từ tháng 9 năm 2007, chế độ thuế được chia thành nhiều mức tỉ lệ khác nhau.
Năm 1998, mức thuế VAT ở Ghana là 10% và được điều chỉnh thành 12.5% vào năm 2000. Tuy nhiên với việc thông qua luật 734 năm 2007, mô hình VAT 3% đối với khu vực bán lẻ bắt đầu được triển khai. Mô hình này chỉ cho phép người bán lẻ các mặt hàng chịu thuế (được quy định theo luật 546) tính thêm tối đa 3% giá trị của mặt hàng được bán so với kê khai. Mục đích của luật này nhằm đơn giản hóa hệ thống thuế và gia tăng sự ủng hộ của người dân. [cần dẫn nguồn]
Từ giữa tháng 12 năm 2010, ngành sản xuất dầu khí tại Ghana đã bắt đầu hoạt động và được kỳ vọng sẽ thúc đẩy tăng trưởng kinh tế (mỏ dầu ngoài khơi Jubilee có trữ lượng lên tới 3 tỷ thùng).[17]
Ghana được bao phủ bởi những đồng bằng, đồi núi thấp và một số sông ngòi. Ghana có thể được chia thành 5 khu vực địa hình khác nhau. Đường bờ biển thấp với các bãi cát xoay lưng về phía đồng bằng và những rừng cây nhỏ, đồng thời bị chia cắt bởi các sông và suối. Trong khi đó, phía bắc của Ghana nổi bật bởi các cao nguyên. Tây Nam và Nam Ghana có được núi rừng che phủ, trong đó có vùng núi Ashanti, cao nguyên Kwahu và Akuapim-Togo chạy dọc sườn đông của đất nước.
Lưu vực sông Volta chiếm một diện tích lớn khu vực trung tâm của Ghana. Điểm cao nhất của Ghana là đỉnh núi Afadjato.
Ghana có khí hậu nhiệt đới. Dải bờ biển phía đông ấm và khô; khu vực tây nam nóng và ẩm ướt, trong khi phía bắc lại nóng và khô. Hồ Volta, hồ nhân tạo lớn nhất thế giới, bao phủ một tỉ lệ không nhỏ phần đất phía đông của Ghana, là nguồn nước chính cho nhiều con sông khác như Oti hoặc Afram.
Khí hậu ở Ghana chia thành 2 mùa chính: mùa mưa và mùa khô. phía bắc Ghana mùa mưa bắt đầu từ tháng 3 cho đến tháng 11, trong khi ở phía nam, bao gồm cả thủ đô Accra, mùa mưa thường bắt đầu từ tháng 4 cho đến trung tuần tháng 11. phía nam của Ghana bao gồm những rừng cây nhiệt đới và rụng lá lớn. Ngoài ra khu vực này còn có những rừng cọ dầu và ngập mặn khác.
Nhóm dân tộc chính ở Ghana là người Akan, trong đó có người Fante, Akyem, Ashanti, Kwahu, Akuapem, Nzema, Bono, Akwamu, Ahanta and others) 49.3%, Mole-Dagbon 15.2%, Ewe 11.7%, Ga-Dangme (comprising of the Ga, Adangbe, Ada, Krobo and others) 7.3%, Guan 4%, Gurma 3.6%, Gurunsi 2.6%, Mande-Busanga 1%, other tribes 1.4%, other (Hausa, Zabarema, Fulani) 1.8% (2000 census).
Theo CIA World Factbook, các nhóm tôn giáo ở Ghana bao gồm: Thiên chúa giáo 68.8%, Hồi giáo 15.9%, tín ngưỡng truyền thống của người Phi 8.5%[20][21].
Ghana cũng là quốc gia đầu tiên của châu Phi giành chiến thắng ở vòng chung kết bóng đá thế giới World Cup 2010 diễn ra tại chính châu lục này sau khi đánh bại Serbia với tỉ số 1-0. Ghana cũng chính là đội tuyển quốc gia châu Phi duy nhất lọt vòng vòng knock-out của giải đấu này và đội bóng thứ 3 châu Phi góp mặt tại vòng tứ kết World Cup.
Hồi giáo là đức tin của 17,6% dân số.[22] Nó được truyền bá đến phía Bắc Ghana trong thế kỷ 15.[24] Kitô giáo và Hồi giáo ở Ghana chung sống hòa bình với nhau.
Điều tra dân số năm 2010 cho biết 5,3% dân số Ghana tuyên bố không có tôn giáo, tôn giáo truyền thống được thực hiện bởi 5,2% dân số, theo điều tra dân số năm 2010. Ấn Độ giáo cũng có mặt ở quốc gia này với một Tu viện do giáo sĩ Swami Ghananand Saraswati điều hành.[25] Đạo giáo và Phật giáo cũng đã xuất hiện ở Ghana do người Trung Quốc mang đến.[26]
http://www.youtube.com/user/hoangkimvietnam
Trở về trang chính
Hoàng Kim, hoangkim, hoangkimvietnam, Ngọc Phương Nam, Chào ngày mới Thung dung, Dạy và học, Cây Lương thực, Tin Nông nghiệp Việt Nam, Food Crops, Cassava in Vietnam, Khát khao xanh, Dayvahoc, Học mỗi ngày, Danh nhân Việt , Food Crops News, Điểm chính, CNM365, Kim LinkedIn, KimTwitter, KimFaceBook Đọc lại và suy ngẫm, Việt Nam tổ quốc tôi, Tình yêu cuộc sống, Thơ cho con
- Trang thiếu chú thích trong bài
- Cựu quốc gia trong lịch sử Việt Nam
- Cựu cộng hòa xã hội chủ nghĩa
- Khởi đầu năm 1945
- Chấm dứt năm 1976
- Chiến tranh Việt Nam
- Cựu quốc gia châu Á
- Việt Nam Dân chủ Cộng hòa
- Quốc gia cổ trong lịch sử Việt Nam
- Chiến tranh Đông Dương
- Vùng phân chia
Ghana
Bách khoa toàn thư mở Wikipedia
| Cộng hoà Ghana | |||||
|---|---|---|---|---|---|
| Republic of Ghana (tiếng Anh) | |||||
|
|||||
| Khẩu hiệu | |||||
| Freedom and Justice (Tiếng Anh: "Tự do và công lý") |
|||||
| Quốc ca | |||||
| God Bless Our Homeland, Ghana | |||||
| Hành chính | |||||
| • Tổng thống | John Dramani Mahama | ||||
| Ngôn ngữ chính thức | Tiếng Anh | ||||
| Thủ đô | Accra |
||||
| Thành phố lớn nhất | Accra | ||||
| Địa lý | |||||
| Diện tích | 238.540 km² (hạng 78) | ||||
| Diện tích nước | 3,5% % | ||||
| Múi giờ | UTC (UTC0) | ||||
| Ngày thành lập | Từ Anh Ngày 6 tháng 3, 1957 |
||||
| Dân cư | |||||
| Dân số ước lượng (2005) | 21.029.853 người (hạng 50) | ||||
| Dân số (2005) | 21.029.853 người | ||||
| Mật độ | 87 người/km² (hạng 83) | ||||
| Kinh tế | |||||
| GDP (PPP) | Tổng số: 54,33 triệu USD | ||||
| HDI (2003) | 0,520 trung bình (hạng 138) | ||||
| Đơn vị tiền tệ | Cedi (GHC) |
||||
| Thông tin khác | |||||
| Tên miền Internet | .gh | ||||
|
Đạo Cơ Đốc 64,1%, tín ngưỡng địa phương 17,6%, đạo hồi 14,4%, Tôn giáo khác 3,9% |
|||||
Người dân Ghana cho rằng lịch sử của họ bắt nguồn từ Vương quốc Ghana cổ xưa tồn tại từ thế kỉ 8 đến thế kỉ 13 tại phía tây châu Phi, nhưng đến khi vương quốc này sụp đổ thì cư dân của nó đã di cư xuống phía nam và lập nên những tiểu quốc Fante và đặc biệt là Vương quốc Ashante hùng mạnh. Những mối liên hệ về thương mại với người Bồ Đào Nha được thiết lập từ thế kỉ 15 và đến năm 1874, Ghana trở thành một thuộc địa của Liên Hiệp Anh với tên gọi Bờ Biển Vàng (Gold Coast). Năm 1957, Ghana trở thành thuộc địa đầu tiên ở vùng Châu Phi hạ Sahara giành được độc lập.
Bờ Biển Vàng giành độc lập từ tay Vương quốc Anh vào năm 1957 và trở thành quốc gia độc lập đầu tiên ở khu vực hạ Sahara.[2][3][4] Ghana được chọn làm tên mới cho quốc gia này để ghi nhớ Đế chế Ghana, đã từng trải dài khắp cả khu vực Tây Phi. Ghana là thành viên của Khu vực hòa bình và hợp tác Nam Đại Tây Dương, Khối thịnh vượng chung, Cộng đồng Kinh tế Tây Phi, Liên minh châu Phi và là thành viên liên kết của Cộng đồng Pháp ngữ. Ghana là nước có sản lượng cacao đứng thứ 2 thế giới. Hồ nhân tạo lớn nhất thế giới về diện tích bề mặt Volta nằm ở quốc gia này.[5]
Mục lục
Từ nguyên học
Ghana có nghĩa là "chiến binh của nhà vua" (ngự lâm quân) gắn liền với những vị vua thời trung đại của đế chế Ghana Tây Phi. Trước khi quốc gia Bờ Biển Vàng (Gold Coast) sáp nhập với Togoland thuộc Anh (British Togoland) vào ngày 6 tháng 3 năm 1957, Ghana trở thành tên pháp lý của quốc gia này. Tuy nhiên, sau khi tuyên bố hoàn toàn độc lập với vương quốc Anh, Ghana đã đổi tên thành Cộng hòa Ghana (Republic of Ghana).Lịch sử
Ghana là một nước có lịch sử lâu đời. Từ thế kỷ 4, đã ra đời Vương quốc Sarakolle rộng lớn, chạy dài từ bờ biển Đại Tây Dương đến sông Niger. Thế kỷ 11, Vương quốc Ghana trở nên cực thịnh với nền nông nghiệp, thủ công, buôn bán phát triển.Từ năm 1471, người Bồ Đào Nha thám hiểm và khám phá ra vùng bờ biển mà sau này có tên gọi là Gold Coast (Côte de l'Or, Bờ biển Vàng). Họ xây dựng pháo đài Elmina và giữ độc quyền buôn bán vàng trong khoảng một thế kỉ rưỡi. Sau khi loại trừ người Bồ Đào Nha, người Hà Lan, người Anh và một số thương gia châu Âu phân chia quyền kiểm soát và biến vùng này thành trung tâm mua bán nô lệ.
Từ năm 1826, người Anh thực hiện một loạt các chiến dịch chống lại người bản xứ Ashanti ở sâu bên trong nội địa. Vùng duyên hải trở thành thuộc địa Anh (1874). Năm 1901, người Ashanti đầu hàng người Anh và lãnh thổ phía bắc trở thành xứ bảo hộ. Vùng Togoland lân cận, thuộc địa cũ của Đức, thuộc quyền ủy trị của Anh từ năm 1922.
Năm 1957, Gold Coast là thuộc địa đầu tiên ở châu Phi giành được độc lập và đổi tên thành Ghana. Nền cộng hòa ra đời sau khi hiến pháp được thông qua (năm 1960). Chủ nghĩa chuyên quyền của Tổng thống Kwame Nkrumah và sự suy thoái kinh tế trong nước dẫn đến cuộc đảo chính quân sự năm 1966.
Từ đó, đất nước rơi vào tình trạng bất ổn chính trị cho đến khi Jerry J. Rawlings lên nắm quyền năm 1981. Rawlings tiến hành khôi phục kinh tế và dân chủ. Được bầu làm Tổng thống năm 1992, Rawlings công bố hiến pháp mới và chấm dứt chế độ quân sự. Ứng cử viên đối lập John Kufuor lên cầm quyền sau khi giành thắng lợi trong cuộc tuyển cử Tổng thống năm 2000.
Chính trị

Tòa án tối cao Ghana, ở Accra
Chính phủ
Nền dân chủ nghị viện của Ghana được xác lập vào năm 1957, xen kẽ bởi các chính phủ quân sự và dân sự. Tháng 1 năm 1993, chính quyền quân đội đã dọn đường cho sự ra đời của nền cộng hòa thứ 4 sau cuộc bầu cử nghị viện và tổng thống vào cuối năm 1992. Hiến pháp năm 1992 thiết lập cơ cấu quyền lực bao gồm tổng thống, nghị viện, nội các, hội đồng nhà nước và một hệ thống toàn án độc lập. Chính phủ được bầu thông qua phổ thông đầu phiếu, tuy nhiện cơ quan lập pháp của Ghana được cơ cấu không theo tỉ lệ, một số tỉnh có dân số ít lại có số đại biểu nhiều hơn các tỉnh có dân số đồng hơn.[8]Hệ thống tòa án
Hệ thống pháp luật dựa trên thông luật của Anh, tiền lệ án, và hiến pháp năm 1992. Hệ thống cấp bậc toà án bao gồm Toà án tối cao Ghana, Toà án cấp phúc thẩm, và Tòa án tư pháp. Các thiết chế tư pháp ngoài toà án là các Toà án công cộng. Từ khi giành độc lập cho đến nền cộng hòa thứ 4, các Toà án đã và đang duy trì được tính độc lập tương đối.[8]Chính trị
Các đảng phái chính trị được hoạt động hợp pháp từ giữa năm 1992 sau 10 năm bị gián đoạn. Nền cộng hòa thứ 4 xuất hiện rất nhiều đảng phái khác nhau, bao gồm Đảng Đại hội quốc gia dân chủ (đã giành chiến thắng trong cuộc bầu cử tổng thống và nghị viện vào các năm 1992, 1996 và 2008) và Đảng Những người ái quốc mới, đảng đối lập đã giành chiến thắng trong các năm 2000 và 2004; Đảng Hội nghị quốc gia nhân dân và Đảng Hội nghị nhân dân, do Kwame Nkrumah sáng lập.[8]Ngoại giao
Từ khi giành độc lập, Ghana luôn ủng hộ xu hướng không liên kết và chủ nghĩa Pan-Africanism gắn liền với tên tuổi của vị tổng thống đầu tiên, TS. Kwame Nkrumah. Ghana ưu tiên các quan hệ hợp tác quốc tế và khu vực về chính trị cũng như kinh tế, đồng thời cũng là một thành viên tích cực của Liên hợp quốc và Liên minh Châu Phi.[cần dẫn nguồn]Ghana thực hiện đường lối đối ngoại đa dạng hoá, đa phương hoá, coi trọng quan hệ với Mỹ, Tây Âu, Nhật Bản để tranh thủ vốn, kỹ thuật. Ghana nhận được sự trợ giúp của Mỹ trong khuôn khổ chương trình “đào tạo các chuyên gia quân sự nước ngoài” (IMET), chương trình “trợ giúp trong việc huấn luyện tiến hành các hoạt động chống khủng bố tại châu Phi” (ACOTA).
Nhiều chính trị gia và nhà ngoại giao Ghana đang làm việc tại các tổ chức quốc tế, trong số đó phải kể đến cựu Tổng thư ký Liên hợp quốc Kofi Annan, thẩm phán Tòa án hình sự quốc tế Akua Kuenyehia và cựu tổng thống Jerry Rawlings, đang là chủ tịch của Cộng đồng kinh tế Tây Phi.[8]
Ghana hiện là thành viên tích cực của nhiều tổ chức khu vực và quốc tế như: WTO, Phong trào không liên kết (NAM), Liên minh châu Phi (AU), Cộng đồng Kinh tế Tây Phi (ECOWAS).
Kinh tế

Tòa nhà Sunyani Cocoa
Năm 2008, lực lượng lao động của Ghana có khoảng 11,5 triệu người.[15] Kinh tế của Ghana chủ yếu vẫn dựa vào nông nghiệp, chiếm tới 37,3% GDP và cung cấp việc làm cho 56% số người lao động,[15] phần lớn trong số đó là những người sản xuất nhỏ. Tỉ trọng công nghiệp của Ghana vào năm 2007 chiếm 7,9% GDP.[16]
Những chính sách không mấy hiệu quả của chính quyền quân sự cũ và các cam kết giữ gìn hòa bình khu vực đã dẫn đến tình trạng lạm phát thâm hụt tài chính, sự sụt giá của đồng Cedi cũng như sự không hài lòng của công chúng với những biện pháp kém cỏi của chính phủ Ghana. Mặc dầu vậy, Ghana vẫn là một trong những quốc gia ổn định về kinh tế nhất châu lục Đen.
Tháng 7 năm 2007, Ngân hàng nhà nước Ghana quyết định thay đổi đồng tiền đang sử dụng Cedi (¢) sang đồng Ghana Cedi (GH¢) để tái kiểm soát tiền tệ trong nước. Tỉ giá của thu đổi là 1 Ghana Cedi cho 10,000 Cedi (cũ). Ngân hàng nhà nước Ghana đã tiến hành các chiến dịch truyền thông mạnh mẽ nhằm thông báo cho người dân Ghana về chính sách này.
Đồng tiền mới, Ghana Cedi, đã dần đi vào ổn định và đến năm 2009 trung bình $1 USD =Gh¢ 1.4 [15]. Thuế giá trị gia tăng (VAT) cũng được áp dụng ở Ghana bắt đầu từ năm 1989 với một mức tỉ lệ áp dụng chung cho tất cả (các loại hàng hóa hoặc cá nhân). Bắt đầu từ tháng 9 năm 2007, chế độ thuế được chia thành nhiều mức tỉ lệ khác nhau.
Năm 1998, mức thuế VAT ở Ghana là 10% và được điều chỉnh thành 12.5% vào năm 2000. Tuy nhiên với việc thông qua luật 734 năm 2007, mô hình VAT 3% đối với khu vực bán lẻ bắt đầu được triển khai. Mô hình này chỉ cho phép người bán lẻ các mặt hàng chịu thuế (được quy định theo luật 546) tính thêm tối đa 3% giá trị của mặt hàng được bán so với kê khai. Mục đích của luật này nhằm đơn giản hóa hệ thống thuế và gia tăng sự ủng hộ của người dân. [cần dẫn nguồn]
Từ giữa tháng 12 năm 2010, ngành sản xuất dầu khí tại Ghana đã bắt đầu hoạt động và được kỳ vọng sẽ thúc đẩy tăng trưởng kinh tế (mỏ dầu ngoài khơi Jubilee có trữ lượng lên tới 3 tỷ thùng).[17]
Vùng và khu hành chính
|
|
|
Dân số của các thành phố lớn
| Thành phố | Dân số |
|---|---|
| Accra | 3.963.264 |
| Kumasi | 2.604.909 |
| Tamale | 390,730 |
| Takoradi | 260,651 |
| Tema | 229,106 |
| Teshie | 154,513 |
| Sekondi | 153,900 |
| Cape Coast | 200,204 |
| Obuasi | 147,613 |
| Dunkwa-On-Offin | 108,482 |
Địa lý
Ghana được bao phủ bởi những đồng bằng, đồi núi thấp và một số sông ngòi. Ghana có thể được chia thành 5 khu vực địa hình khác nhau. Đường bờ biển thấp với các bãi cát xoay lưng về phía đồng bằng và những rừng cây nhỏ, đồng thời bị chia cắt bởi các sông và suối. Trong khi đó, phía bắc của Ghana nổi bật bởi các cao nguyên. Tây Nam và Nam Ghana có được núi rừng che phủ, trong đó có vùng núi Ashanti, cao nguyên Kwahu và Akuapim-Togo chạy dọc sườn đông của đất nước.
Lưu vực sông Volta chiếm một diện tích lớn khu vực trung tâm của Ghana. Điểm cao nhất của Ghana là đỉnh núi Afadjato.
Ghana có khí hậu nhiệt đới. Dải bờ biển phía đông ấm và khô; khu vực tây nam nóng và ẩm ướt, trong khi phía bắc lại nóng và khô. Hồ Volta, hồ nhân tạo lớn nhất thế giới, bao phủ một tỉ lệ không nhỏ phần đất phía đông của Ghana, là nguồn nước chính cho nhiều con sông khác như Oti hoặc Afram.
Khí hậu ở Ghana chia thành 2 mùa chính: mùa mưa và mùa khô. phía bắc Ghana mùa mưa bắt đầu từ tháng 3 cho đến tháng 11, trong khi ở phía nam, bao gồm cả thủ đô Accra, mùa mưa thường bắt đầu từ tháng 4 cho đến trung tuần tháng 11. phía nam của Ghana bao gồm những rừng cây nhiệt đới và rụng lá lớn. Ngoài ra khu vực này còn có những rừng cọ dầu và ngập mặn khác.
Dân cư
Dân số Ghana vào khoảng 24 triệu người bao gồm hơn 100 nhóm dân tộc khác nhau. Tuy vậy, ở Ghana không có những xung đột dân tộc gay gắt có thể dẫn đến nội chiến như ở nhiều nước châu Phi khác.[19] Ngôn ngữ chính thức ở Ghana là tiếng Anh tuy nhiên hầu hết người dân Ghana đều biết ít nhất một thổ ngữ.Nhóm dân tộc chính ở Ghana là người Akan, trong đó có người Fante, Akyem, Ashanti, Kwahu, Akuapem, Nzema, Bono, Akwamu, Ahanta and others) 49.3%, Mole-Dagbon 15.2%, Ewe 11.7%, Ga-Dangme (comprising of the Ga, Adangbe, Ada, Krobo and others) 7.3%, Guan 4%, Gurma 3.6%, Gurunsi 2.6%, Mande-Busanga 1%, other tribes 1.4%, other (Hausa, Zabarema, Fulani) 1.8% (2000 census).
Theo CIA World Factbook, các nhóm tôn giáo ở Ghana bao gồm: Thiên chúa giáo 68.8%, Hồi giáo 15.9%, tín ngưỡng truyền thống của người Phi 8.5%[20][21].
Ngôn ngữ
Ở Ghana có 47 thổ ngữ. Tiếng Anh là ngôn ngữ chính thức của Ghana trong thương mại cũng như hành chính. Tiếng Anh cũng là ngôn ngữ tiêu chuẩn để giảng dạy ở các cấp giáo dục. Ngôn ngữ bản địa của Ghana được chia thành hai nhóm nhỏ thuộc nhóm ngôn ngữ Niger-Congo.Văn hóa và con người
Ghana là một quốc gia đa dạng về thành phần dân tộc. Do đó, văn hóa của Ghana là sự pha trộn của tất cả các nền văn hóa của mọi nhóm dân tộc của quốc gia này: người Ashanti, người Fante, người Kwahu, người Ga, người Ewe, người Mamprusi, người Dagomba và các nhóm dân tộc thiểu số khác. Sự đa dạng văn hóa này thể hiện rất rõ trong cách ăn, cách mặc và nghệ thuật của người dân Ghana. Một số nghi lễ đặc trưng của văn hóa Ghana cho đến hiện tại vẫn còn rất phổ biến ở quốc gia này như lễ sinh con, lễ trưởng thành, kết hôn và ma chay.Thể thao
Ở Ghana, bóng đá là môn thể thao phổ biến và được yêu thích nhất. Đội tuyển bóng đá quốc gia Ghana thường được gọi là "Những ngôi sao đen". Ngày 16 tháng 10 năm 2009, đội tuyển bóng đá U-20 Ghana đã trở thành đội tuyển quốc gia đầu tiên của châu Phi đoạt ngôi vô địch U-20 thế giới sau chiến thắng ở loạt sút luân lưu 11m với Brasil.Ghana cũng là quốc gia đầu tiên của châu Phi giành chiến thắng ở vòng chung kết bóng đá thế giới World Cup 2010 diễn ra tại chính châu lục này sau khi đánh bại Serbia với tỉ số 1-0. Ghana cũng chính là đội tuyển quốc gia châu Phi duy nhất lọt vòng vòng knock-out của giải đấu này và đội bóng thứ 3 châu Phi góp mặt tại vòng tứ kết World Cup.
Tôn giáo
Kitô giáo là tôn giáo lớn nhất của đất nước, và chiếm ưu thế ở phía nam Ghana và các bộ phận của miền Bắc Ghana, trong khi Hồi giáo phổ biến rộng rãi hơn trong các bộ phận của khu vực phía Bắc. Kitô giáo được theo bởi 71,2% dân số, theo điều tra dân số năm 2010.[22] Kitô giáo đã được giới thiệu bởi người châu Âu trên bờ biển của Ghana trong thế kỷ 14, và dần dần người dân nước này đã tin theo tôn giáo mới.[23]Hồi giáo là đức tin của 17,6% dân số.[22] Nó được truyền bá đến phía Bắc Ghana trong thế kỷ 15.[24] Kitô giáo và Hồi giáo ở Ghana chung sống hòa bình với nhau.
Điều tra dân số năm 2010 cho biết 5,3% dân số Ghana tuyên bố không có tôn giáo, tôn giáo truyền thống được thực hiện bởi 5,2% dân số, theo điều tra dân số năm 2010. Ấn Độ giáo cũng có mặt ở quốc gia này với một Tu viện do giáo sĩ Swami Ghananand Saraswati điều hành.[25] Đạo giáo và Phật giáo cũng đã xuất hiện ở Ghana do người Trung Quốc mang đến.[26]
Giáo dục
Xếp hạng quốc tế
| Tổ chức | Khảo sát về | Xếp hạng |
|---|---|---|
| Institute for Economics and Peace [3] | Chỉ số chung về hòa bình (Global Peace Index)[27] | 52 trên 144 |
| Heritage Foundation/The Wall Street Journal | Chỉ số tự do kinh tế (Index of Economic Freedom) | 91 trên 157[28] |
| Ký giả không biên giới | Chỉ số tự do báo chí | 31 trên 173[29] |
| Transparency International | Chỉ số nhận thức tham nhũng (Corruption Perception Index) | 69 trên 179[30] |
| Chương trình phát triển của Liên hợp quốc | Chỉ số phát triển con người (Human Development Index) | 135 trên 177[31] |
| Vision of Humanity | Chỉ số chung về hòa bình (Global Peace Index) | 40 trên 121[32] |
| Diễn đàn kinh tế thế giới | Báo cáo cạnh tranh toàn cầu (Global Competitiveness Report) | không được xếp hạng[33] |
Ghi chú
- ^ Trần, Văn Bình; Phan Doãn Nam (2001). Giáo trình Lịch sử quan hệ quốc tế. Hà Nội: Học viện quan hệ quốc tế. tr. 265.
Tham khảo
- ^ Thông tin cơ bản về các nước, khu vực và quan hệ với Việt Nam, Bộ Ngoại Giao Việt Nam.
- ^ Peter N. Stearns and William Leonard Langer. The Encyclopedia of World History: Ancient, Medieval, and Modern, Chronologically Arranged, 2001. Pages 813, 1050.
- ^ “Ghana - MSN Encarta”. Bản gốc lưu trữ ngày 31 tháng 10 năm 2009., encarta.msn.com
- ^ “NEWS.BBC.co.uk”. NEWS.BBC.co.uk. 9 tháng 2 năm 2010. Truy cập ngày 26 tháng 6 năm 2010.
- ^ “Geography.about.com”. Geography.about.com. Truy cập ngày 26 tháng 6 năm 2010.
- ^ “Foreignpolicy.com” (PDF). Truy cập ngày 26 tháng 6 năm 2010.
- ^ “Welcome to the Mo Ibrahim Foundation”. Moibrahimfoundation.org. Truy cập ngày 26 tháng 6 năm 2010.
- ^ a ă â b "Government and Politics". A Country Study: Ghana (La Verle Berry, editor). Library of Congress Federal Research Division (tháng 11 năm 1994). This article incorporates text from this source, which is in the public domain. Lcweb2.loc.gov
- ^ [1] Human Development Indices, Table 3: Human and income poverty, p. 35. Truy cập 1 tháng 6 năm 2009
- ^ “Obama's Ghana trip sends message across Africa”. CNN. 10 tháng 7 năm 2009.
- ^ “Aluworks.com”. Aluworks.com. Truy cập ngày 26 tháng 6 năm 2010.
- ^ The World Factbook
- ^ Ghana leader: Oil reserves at 3B barrels - Yahoo! News
- ^ “Kosmos Makes Second Oil Discovery Offshore Ghana”. Rigzone.com. 25 tháng 2 năm 2008. Truy cập ngày 26 tháng 6 năm 2010.
- ^ a ă â [2][liên kết hỏng]
- ^ “Ghana - MSN Encarta”. Bản gốc lưu trữ ngày 31 tháng 10 năm 2009., encarta.msn.com
- ^ Tài Liệu Cơ Bản Về Ghana Và Quan Hệ Với Việt Nam
- ^ Extreme points of Earth
- ^ “Ghana - MSN Encarta”. Bản gốc lưu trữ ngày 31 tháng 10 năm 2009.
- ^ “International Religious Freedom Report 2007”. U.S. Department of State. Truy cập 5 tháng 12 năm 2009.
- ^ “CIA - The World Factbook - Ghana”. U.S. CIA. Truy cập 5 tháng 12 năm 2009.
- ^ a ă 2010 Population and Housing Census
- ^ Ghana Religion – OverLandingAfrica. overlandingafrica.com. Retrieved 24 February 2010.
- ^ "International Religious Freedom Report 2007". U.S. Department of State. Retrieved 5 December 2009.
- ^ Trisha Gupta (15 August 2009). "Culture & Society – The Swami of Accra". tehelka.com. Tehelka. Retrieved 13 June 2012.
- ^ ^ Rajesh Joshi (29 June 2010). "Ghana's unique African-Hindu temple". bbc.co.uk. BBC News. Retrieved 13 June 2012.
- ^ “Vision of Humanity”. Vision of Humanity. Truy cập ngày 4 tháng 2 năm 2010.
- ^ “Heritage Foundation - 2007 Index of Economic Freedom”. Official Website for the Index. The Wall Street Journal and The Heritage Foundation. Bản gốc lưu trữ ngày 13 tháng 2 năm 2008. Truy cập ngày 24 tháng 2 năm 2007. “The highest form of economic freedom provides an absolute right of property ownership, fully realised freedoms of movement for labour, capital, and goods, and an absolute absence of coercion or constraint of economic liberty beyond the extent necessary for citizens to protect and maintain liberty itself. In other words, individuals are free to work, produce, consume, and invest in any way they please, and that freedom is both protected by the state and unconstrained by the state.”
- ^ “Reporters Without Borders - Worldwide Press Freedom Index 2008”. Annual Worldwide Press Freedom Index. Reporters sans frontières. Truy cập ngày 12 tháng 1 năm 2009.
- ^ “Corruption Perception Index 2007”. Official Website. Transparency International e.V. Truy cập ngày 11 tháng 12 năm 2007.
- ^ “Human Development Report 2006” (PDF). Annual Report. United Nations Development Programme. Bản gốc lưu trữ ngày 29 tháng 10 năm 2007. Truy cập ngày 24 tháng 2 năm 2007.
- ^ “Global Peace Index Rankings”. Global Peace and Sustainability. Economist Intelligence Unit, Centre for Peace and Conflict Studies, University of Sydney, Australia and some Peace Institutes and Think Tanks. Truy cập ngày 30 tháng 5 năm 2007.
- ^ “Table 1: Global Competitiveness Index rankings and 2005 comparisons” (PDF). World Economic Forum - Global Competitiveness Report 2006 - 2007. World Economic Forum. Truy cập ngày 24 tháng 2 năm 2007.
Liên kết ngoài
| Wikimedia Commons có thêm thể loại hình ảnh và tài liệu về Ghana |
| Tìm hiểu thêm về Ghana ở các dự án khác của Wikipedia: | |
| Định nghĩa ở Wiktionary | |
| Nội dung đa phương tiện ở Commons | |
| Tư liệu học tập ở Wikiversity | |
| Tin tức ở Wikinews | |
| Câu nói nổi tiếng ở Wikiquote | |
| Văn bản ở Wikisource | |
| Sách ở Wikibooks | |
- Business Anti-Corruption Portal Ghana country profile
- Chính phủ
- Ghana official website
- The Parliament of Ghana official site
- National Commission on Culture official site
- Chief of State and Cabinet Members
- Thông tin chung
- Country Profile from BBC News
- Ghana from Encyclopaedia Britannica
- Ghana from UCB Libraries GovPubs
- Ghana tại Dự án thư viện mở (trang đề nghị)
 Wikimedia Atlas của Ghana, có một số bản đồ liên quan đến Ghana.
Wikimedia Atlas của Ghana, có một số bản đồ liên quan đến Ghana.- The African Activist Archive Project website has photographs of the All Africa People's Conference held in Accra, Ghana, 5–13 December 1958 including Kwame Nkrumah, Prime Minister of Ghana, addressing the conference, the American Committee on Africa delegation meeting with Nkrumah, and of Patrick Duncan and Alfred Hutchinson of South Africa at the conference.
- Key Development Forecasts for Ghana from International Futures
- Thể thao
|
|
|||
|
|
||
http://www.youtube.com/user/hoangkimvietnam
Trở về trang chính
Hoàng Kim, hoangkim, hoangkimvietnam, Ngọc Phương Nam, Chào ngày mới Thung dung, Dạy và học, Cây Lương thực, Tin Nông nghiệp Việt Nam, Food Crops, Cassava in Vietnam, Khát khao xanh, Dayvahoc, Học mỗi ngày, Danh nhân Việt , Food Crops News, Điểm chính, CNM365, Kim LinkedIn, KimTwitter, KimFaceBook Đọc lại và suy ngẫm, Việt Nam tổ quốc tôi, Tình yêu cuộc sống, Thơ cho con

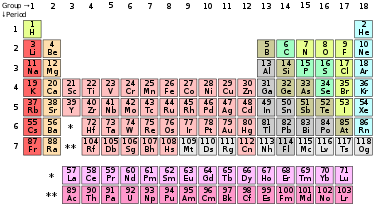
































No comments:
Post a Comment